
题目列表(包括答案和解析)
未注意电离或水解的有效性
NaHSO4=Na++H++ SO42- (水溶液中,1mol离解出3mol离子)
NaHSO4=Na++HSO4- (熔融状态下,1mol离解出2mol离子)
NaHCO3= Na++HCO3- (水溶液中)
NaHCO3 (注意熔融状态下,会分解)
S2-+2H2O H2S+2OH-
H2S+2OH-
未注意反应物的完整性
等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
HCO3-+OH-+Ba2+=BaCO3↓+H2O
氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
未注重反应的定量关系
将标准状况下67.2 mL氯气通入20 mL 0.2 mol/L的溴化亚铁溶液中: 2Fe2++6Br-+4Cl2=2Fe3++8Cl-+3Br2
未注意反应的本质
次氯酸钙溶液中通入少量二氧化硫:Ca(ClO)2+H2O+SO2=CaSO3↓+2HClO
未注意电解质的拆分
硫代硫酸钠溶液中加入适量稀硫酸:N a2S2O3+2H+=2 N a++S↓+SO2↑+H2O
★特别小心两级电离方程式不一样的情况。
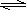 某二元酸(H2A)按下式发生电离:H2A
= H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
某二元酸(H2A)按下式发生电离:H2A
= H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液 ②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A.溶液①中一定不存在OH-
B.四种溶液中c(HA-)浓度大小:③>①>②>④
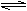 C.溶液②中存在水解平衡:HA-+H2O
H2A+OH-
C.溶液②中存在水解平衡:HA-+H2O
H2A+OH-
D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)
可以一般离子共存题
一定前提条件下的离子共存题(颜色、酸碱性、酸碱两可性)
如:在强碱溶液中:Na+、K+、AlO2-、CO32-
特定反应的离子共存题(因氧化还原、复分解、双水解、络合)
如:在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
在由水电离出的c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
离子分组题(工厂废水排放问题等)
离子共存大前提--存在的即是合理的,不存在的必须找准相互间的反应
如:NH4+、HCO3-能够大量共存
在pH=1的溶液中:K+、Fe2+、Cl-、NO3-因氧化还原反应而不能大量共存
10、不在阿伏加得罗常数本身设置陷阱,而在性质理解上设限,如把NaCl、SiO2说成分子
9、未读准题干,如题干中只有浓度或pH值而根本没有体积,不能计算物质的量
8、特殊物质的物态不明(如通常状况下SO3为固体、X>4时CXHY为液体或固体,除几种特殊情况外,烃的衍生物一般为液态或固态)
7、细节设置易错点(如加倍或减半、小数点挪位等)
6、为进一步考虑物质间的反应或转化(如NO和N2、N2O4和NO2)
5、过于僵化体积与状况的关系,液体有时也可用体积(如水,因为通常状况下密度为1)
4、混淆气体摩尔体积的使用对象(固体、气体等)
3、忽略所描述物质组成和结构的变化(如分子、原子、质子、中子、电子、阳离子、离子总数、分子总数等)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com