
题目列表(包括答案和解析)
24.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
 +4H++3e¾®NO+2H2O
+4H++3e¾®NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:______________________________________
(2)反应中硝酸体现了_____、_____性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是_____mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_________
23.(A)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有_____种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是_____(用元素符号表示,下同)。
(2)元素Y与氢元素形成一种离子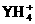 ,写出该微粒的电子式
,写出该微粒的电子式
(3)元素Z与元素T相比,非金属性较强的是_____,下列表述中能证明这一事实的是_____
A.常温下Z的单质和T的单质状态不同 B.Z的氢化物比T的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是__________,理由是______________ ______________________________________________
(B)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
|
X |
L层p电子数比s电子数多2个 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________
写出元素Z的气态氢化物的电子式__________(用元素符号表示,下同)。
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是_____,下列表述中能证明这一事实的是_____
A.常温下氯气的颜色比T单质的颜色深 C.氯与T形成的化合物中氯元素呈正价态
B.T的单质通入氯化钠水溶液不能置换出氯气
(4)探寻物质的性质差异性是学习的重要方法之-。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是_____,理由__________________________________
25.(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______________,K值大小与温度的关系是:温度升高,K值__________(填:增大、减小、不一定)。
(2)在一体积为10 L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)+Q(Q>0)
CO2(g)+H2(g)+Q(Q>0)
CO和H2O浓度变化如下图,则 0-4 min的平均反应速率v(CO)=______ mol/(L·min)
(3)t℃(t>850)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
① 表中3 min-4 min之间反应处于__________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
② 反应在4 min-5 min问,平衡向逆方向移动,可能的原因是_____,
表中5 min-6 min之间数值发生变化,可能的原因是_____。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
2007年
24.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
__________+__________¾®__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_____
(3)反应中1 mol氧化剂_____(填:得到、失去)_____mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
__________+__________¾®
23.(B)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
(1)请在下表中用实线补全元素周期表边界。
(2)元素 ⑤ 的原子核外p电子数比s电子总数多_____个。
元素 ③ 氢化物的电子式为__________
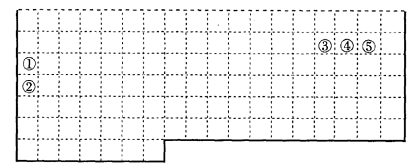
(3)元素 ④ -般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素 ① 的单质、元素 ② 的单质和元素 ① ② 形成的合金这三种物质中,熔点最低的是_____
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
23.(A)
 (1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:_____>_____
甲、乙的最高价氧化物水化物的酸性强弱为:__________>__________(用化学式表示)
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的______,请写出元素在元素周期表中的位置与元素原子结构的关系:________________________
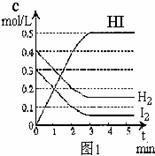
25.在某一容积为2L的密闭容器内,加入0.8
mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g) 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为_______________
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为__________
(3)反应达到平衡后,第8分钟时:
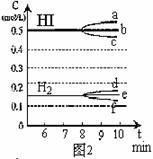
① 若升高温度,化学平衡常数K__________(填:增大、减小、不变),HI浓度的变化正确_____(用图2中a-c的编号回答);
② 若加入I2,H2浓度的变化正确的是_____(用图2中d-f的编号回答)。
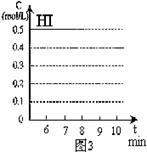
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
2006年
24.(B)
(1)在上面元素周期表中全部
是金属元素的区域为_____
(a)A (b)B
(c)C (d)D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是_____
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是_____(填名称),可以验证该结论的实验是_____
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
23.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2¾®O2。
(1)该反应中的还原剂是__________
(2)该反应中,发生还原反应的过程是__________¾®__________
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________________
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_____
24.(A)
(1)在上面元素周期表中画出
金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提
议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的_____族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是_____(填名称),
|
25. 右表是元素周期表的一部分。
右表是元素周期表的一部分。
(1)表中元素 ⑩ 的氢化物的化学式
为_____,此氢化物的还原性比元素 ⑨
的氢化物的还原性_____(填:强、弱)。
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是_____,其单质的电子式为__________。
(3)俗称为“矾”的一类化合物通常含有共同的元素是__________
(4)已知某些不同族元素的性质也有一定的相似性,如元素 ③ 与元素 ⑧ 的氢氧化物有相似的性质。写出元素 ③ 的氢氧化物与NaOH溶液反应的化学方程式:
____________________________________________
又如表中与元素 ⑦ 的性质相似的不同族元素是_____(填元素符号)。
2005年
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com