
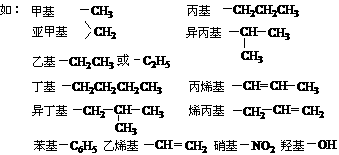
题目列表(包括答案和解析)
1、基和根的比较
(1) “基”指的是非电解质(如有机物)分子失去原子或原子团后残留的部分。
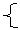
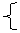
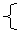
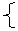
(2)“根”指的是电解质由于电子转移而解离成的部分。如:OH-、CH3+、NH4+等.
两者区别:基中含有孤电子,不显电性,不能单独稳定存在;根中一般不含孤电子,显电性,
大多数在溶液中或熔化状态下能稳定存在。
如:-OH的电子式为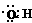 ,OH-的电子式为
,OH-的电子式为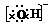 。
。
27.(8分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+ 10Al + 18H2O → 3N2↑+ 10Al(OH)3 + 6OH-
(1)现在要除去1m3含氮元素0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝__________g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
① 写出镁和含氮废水反应的离子方程式:___________________________________
② 已知金属镁是从海水中提取的MgCl2,通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水_________ kg。
26.(6分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)反应后生成硫酸铜的质量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
25.(8分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
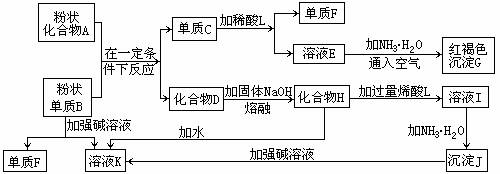 (1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
24.(10分)(2004年天津高考题)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水
③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
23.(12分)盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反应情况,填空回答下列问题:
(1)我们知道,稀盐酸不与Cu反应。在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为 。
(2)在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)lOOmL。
若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是 。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
22. (12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料 生产SO2,反应的化学方程式为:
,该反应在 中进行。
(12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料 生产SO2,反应的化学方程式为:
,该反应在 中进行。
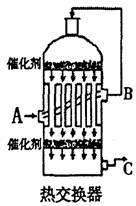
(2)为了有利于SO2的转化为SO3,且能充分利用热能,采 用 了多层催化剂间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则C处流出的气体为 ,A、B、C三处气体的温度由高到低的顺序为 。
(3)在吸收塔中用 吸收SO3,从吸收塔上部导出的气体再次通入 ,进行第二次氧化,再进行一次吸收后将尾气中很少的SO2净化回收,以防污染大气。
21.(4分)古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸部,商人们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体。你认为这种固体可能是____________,其主要成分是________________________。
20.(10分)(2003上海高考题)工业上测量SO2、N2、O2混合气体中SO2含量的装置如下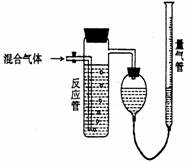 图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的 体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气, 则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4)若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶
e.量筒 f.单孔塞 g.双孔塞
19.(8分)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Fe(Al)______________ ___ (2)NH3(H2O)____________________-
(3)NO(NO2)_______________________ (4)NaCl溶液(Na2SO4)____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com