
题目列表(包括答案和解析)
2.为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置应分别装入 ( )
A.饱和Na2CO3溶液;无水CaCl2
B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和NaHCO3溶液
D.饱和NaHCO3溶液;稀H2SO4
1.(2009年长春模拟)下列关于实验室制取气体所用试剂的组合中不合理的是 ( )A.制Cl2:MnO2、HCl(浓)
B.制NH3:浓氨水、生石灰
C.制NO:HNO3(稀)、Cu
D.制CO2:H2SO4(稀)、大理石
12.(2009年启东模拟)铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是____________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4粉末:
____________ 。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法):____________ 。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化
①实验中应将Fe2O3放在____________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由____________变为____________ ,
说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?____________(填“能”或“不能”)。理由是____________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为____________,但是,实验结果是固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________。
④比较两种方法,你认为较好的方法是____________。
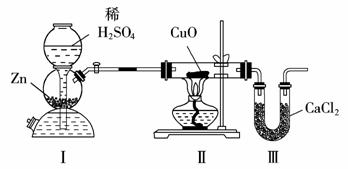
11.(2009年宁夏卷)碱式碳酸铜可表示为:
xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答下列问题:
①写出xCuCO3·yCu(OH)2y·zH2O与氢气反应的化学方程式____________ ;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
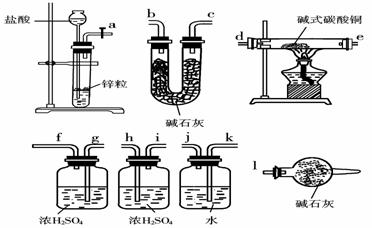
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为____________g,化学式为____________;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认识是否可行?请说明理由。____________ 。
10.(2009年安徽卷)某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
|
|
[FK)]

(1)第①步反应的离子方程式是____________ 。
(2)第②步中用pH试纸测定溶液pH的操作是:____________ 。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有____________。
(4)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入____________g FeSO4·7H2O。
9.某校化学课外小组组织了对农家小化工厂的科技创新活动。
(1)在分析实验室里:①需取用12.50 mL稀H2SO4溶液,学生选用三种量具:A量筒 B移液管 C酸式滴定管,仪器选用正确的是____________(填选项号)。
②读取实验①中读数时,视线与凹液面相切,出现了三种情形。
A.俯视 B.平视 C.仰视
若测定该硫酸溶液浓度且中和滴定的其他操作正确,则导致结果偏高的原因是____________(填选序号)。
③用标准碱液测定硫酸溶液浓度,学生选用的指示剂有下列三种:
A.石蕊
B.甲基橙
C.酚酞
其中使用效果最好的是____________。
(2)在试剂车间,技术员提出了制备氢氧化铝的三种工艺过程:
ⅰ.Al Al3+
Al3+ Al(OH)3
Al(OH)3
ⅱ.AlNaOH AlO2-
AlO2- Al(OH)3
Al(OH)3
 ⅲ.Al
ⅲ.Al Al3+
Al3+
 Al(OH)3
Al(OH)3
Al AlO2-
AlO2-
试从成本、环保达标等方面评价,第____________种工艺最优。
(3)根据市场的需求,厂长请学生设计开发胆矾产品的方案。学生们设计了以下三种方案:方案甲:废铜屑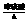 CuSO4溶液
CuSO4溶液 CuSO4·5H2O
CuSO4·5H2O
方案乙:废铜屑 CuSO4溶液
CuSO4溶液 CuSO4·5H2O
CuSO4·5H2O
方案丙:废铜屑 CuO
CuO CuSO4溶液
CuSO4溶液 CuSO4·5H2O
CuSO4·5H2O
则合理可行的方案为____________。
8.用下列实验装置完成对应的实验,能达到实验目的的是( )

7.(2010年海南中学)关于下列各装置图的叙述中,不正确的是( )
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,(NH3和HCl不溶于CCl4)并可防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
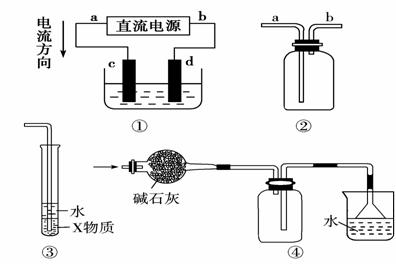
6.(2009年泰安模拟)用如下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得?m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是( )
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.CuO没有全部被还原
5.(2009年广东五校模拟)在下列实验中,不能达到目的的是( )
A.Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S
B.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜的镁的金属活动性强弱
C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
D.测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com