
题目列表(包括答案和解析)
4.CS2是一种有恶臭的液体,它滴入用H2SO4酸化的KMnO4溶液时,有黄色沉淀析出,并放出CO2气体,当产生0.5molCO2时,转移的电子数目是 ( )
A.NA B.2NA C.3NA D.4NA
3.某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是 ( )
A.KMnO4 B.Na2CO3 C.(NH4)2SO4 D.CH3COOH
2.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是 ( )
A.酸 B.漂白剂 C.还原剂 D.氧化剂
1.据世界卫生组织统计,全球约有8000万妇女使用避孕环,常用避孕环都是含金属铜的。据认为,金属铜的避孕机理之一是:铜与子宫分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性,能杀死精子。下列说法或表示正确的是 ( )
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
30.(14分)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目。
如:(CH3)2C=CH-CH3 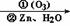 (CH3)2C=O+CH3CHO
(CH3)2C=O+CH3CHO
已知某有机物A经臭氧氧化分解后发生下列一系列的变化:
试回答下列问题:
(1)有机物A的结构简式为: ,其中所含的官能团为: (填官能团的名称)。
(2)从B合成E通常要经过几步反应,其中最佳的次序应是 。
A、水解、酸化、氧化 B、氧化、水解、酸化
C、水解、酸化、还原 D、氧化、水解、酯化
(3)写出下列变化的化学方程式:
①H水解生成E和G: ,
②C制D: 。
(4)E有多种同分异构体,请写出符合下列条件的E的同分异构体的结构简式:
①与FeCl3溶液反应,溶液呈紫色;
②能与银氨溶液发生银镜反应;
③苯环上的一溴代物有2种;
29.(16分)已知:以铜作催化剂,用空气氧化醇制取醛,事实上是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。某实验室中用甲醇、水、空气和铜粉(或氧化铜)制取甲醛的水溶液。下表给出甲醇、甲醛的沸点和水溶性:
|
|
沸点/℃ |
水溶性 |
|
甲醇 |
65 |
与水混溶 |
|
甲醛 |
-21 |
与水混溶 |
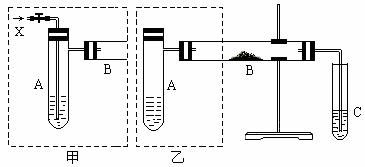 下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示
下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示
请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是____________________。
(2)若按甲装置进行实验,则通入A的X是______,B中发生反应的化学方程式为__________________________。(有机分子用结构简式表示)
(3)若按乙装置进行实验,则B管中应装入的物质是_____,B管中的现象为 。
(4)两套装置中都需要加热的仪器有______(填A、B、C)。
(5)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好?______(填“甲”或“乙”)。
(6)验证实验后试管C中含有甲醛,所用试剂是__________。
28.(16分)现有部分元素的存在、性质或原子结构如下表所示:
|
A |
最外层电子数是次外层电子数的2倍的元素 |
|
B |
最高正价为+7价的短周期元素 |
|
C |
最外层电子数等于电子层数的短周期元素 |
|
D |
地壳中含量居第二位的金属元素 |
|
E |
其氢化物在同主族元素氢化物中熔沸点最高 |
|
F |
短周期元素中原子半径(除稀有气体外)最大的元素 |
请回答下列问题:
(1)写出由上述条件可以确定的元素的元素符号: 。
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为: ,空间构型为: 。
(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系。其中甲、乙、丙为含有同一种元素的纯净物(反应条件略)。
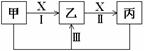 ①Ⅰ、若X为非金属元素的单质,图中反应均为氧化还原反应,
①Ⅰ、若X为非金属元素的单质,图中反应均为氧化还原反应,
则X为 (填化学式),反应Ⅲ的化学方程式为 。
Ⅱ、若X为金属元素的单质,图中反应均为氧化还原反应,
则X为 (填化学式),反应Ⅲ的化学方程式为 。
②若X为HCl,图中反应均为非氧化还原反应,则可能的情况有多种,试写出其中两种:
第一种:甲为 (填化学式),反应Ⅲ的离子方程式为 。
第二种:甲为 (填化学式),反应Ⅲ的离子方程式为 。
27.(14分)化学反应:2SO2(g)+O2(g) 2SO3(g);△H<0。
2SO3(g);△H<0。
(1)若将4 mol SO2和2 molO2在2L的容器中混合,经2 s 后测得SO3的浓度为0.6 mol·L-1,用SO2表示该反应的平均反应速率为 ,2 s 末O2的浓度为 。
(2)若把amol SO2和bmolO2充入一密闭容器中,反应达到平衡时它们的物质的量满足:
n (SO2) +n (O2) =n (SO3),则SO2的转化率为 (用含a、b的代数式表示)。
(3)若将4 mol SO2和2 molO2加入体积可变的恒压容器中,一定温度下反应达到平衡状态,测得气体的总物质的量为4.2 mol,此时,平衡混合气体中SO3的体积分数为 。
(4) 如果在甲、乙两个恒容密闭容器内,向甲中充入2molSO2与1mol O2,,乙中充入1molSO2与0.5mol O2,控制在420℃下,使上述甲、乙两个容器中反应均达到平衡,此时测得甲、乙两个容器中SO2的体积分数都为0.2,则两容器的体积关系V(甲)= V(乙)(填数字)。
(5) 某学生模仿工业上SO2氧化的实验,为提高SO2被氧化的速率可采取的措施是 ,(填写序号字母);能提高SO2的转化率可采取的措施是 (填写序号字母)。
a.使用催化剂 b.提高反应温度 c.适时转移走产物 d.通入过量的O2
13.在两个密闭容器中,分别充入质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是
A.若M(甲)>M(乙),则分子数:甲>乙
B.若M(甲)<M(乙),则气体摩尔体积:甲>乙
C.若M(甲)<M(乙),则气体的压强:甲>乙
D.若M(甲)>M(乙),则气体体积:甲<乙
12.在铁和铜的混合物中加入一定量的稀HNO3,经充分反应,剩余部分金属,再继续向其中加入足量的稀H2SO4,又有部分金属溶解,加入稀H2SO4前溶液中肯定不含:
A.Fe2+ B.Fe3+ C.Cu2+ D.Cu2+和Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com