
题目列表(包括答案和解析)
8.(2010·长沙模拟)a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.①③ D.②④
[解析]选D。在此反应中硝酸分两部分参加反应即硝酸的总量=被还原的硝酸的量+未被还原的硝酸的量,由铁原子守恒和氮原子守恒可知n(未被还原的硝酸)=3n[Fe(NO3)3],m(未被还原的硝酸)=(a+b)×3×63=(a+b)×189g;由得失电子相等可以求出被还原的硝酸的物质的量:a×(3-2)+a×[6-(-2)]+b×(3-2)=n(被还原的硝酸)×(5-2) n(被还原的硝酸)= (9a+b)/3mol,n(未被还原的硝酸)=n(总硝酸)-n(被还原的硝酸)= Vc-(9a+b)/3mol因此D选项正确。
7.(2010·姜堰模拟)下列叙述正确的是( )(用NA代表阿伏加德罗常数的值)
A.2.7g金属铝变为铝离子时失去的电子数为0.3NA
B.标准状况下,5.6L一氧化氮和5.6L氧气混合后的气体中分子总数为0.5NA
C.在标准状况下,体积均为22.4L的CH4与H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4L的CO气体与1molN2所含的电子数相等
[解析]选A。Al→Al3+,0.1mol Al失去0.3mol的电子,A选项正确;一氧化氮和氧气反应会生成二氧化氮,混合后分子总数会小于0.5NA,B选项错误;标况下水是液体,C选项错误;D选项未给出标况下,22.4L的CO气体可能不是1molCO,因此D选项错误。
6.(2010·南京模拟)下列有关工业生产的叙述中,错误的是 ( )
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.炼铁的主要原理是在高温下,用还原剂从铁矿石中把铁还原出来
[解析]选C。如果吸收塔内用水吸收三氧化硫会形成酸雾,工业上是用浓硫酸来吸收三氧化硫。
5.(2010·湖南师大附中模拟)在常温常压下,在a、b、c、d四支相同的试管中,分别装入等物质的量混合的两种气体。a试管内是NO2和O2;b试管内是Cl2和SO2;c试管内是NO和O2;d试管内是CO和O2。将四支试管迅速同时倒立于水中,最后水面上升高度h的比较正确的是( )
A、b>c>a>d B、 c>a>b>d C、d>a>c>b D、b>a>c>d
[解析]选A。假设试管中的气体分别为1mol ,那么试管a中剩余3/4mol 的O2, 试管b中无气体剩余, 试管c中剩余1/4mol 的O2,试管d中CO和O2均难溶于水,试管中剩余气体越少水面上升高度越高,因此A选项正确。
4.(2010·南京模拟).研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.加入少量H2SO4使淀粉水解
B.碳酸钠与硫酸反应
C.向铜和双氧水的混合物中加入硫酸
D.潮湿的氯气通过盛有浓H2SO4的洗气瓶
[解析]选A。观察题干信息可知,NO2起到了催化剂的作用,A选项中H2SO4起了催化剂的作用;B、C选项中H2SO4作为反应物;D选项中浓H2SO4起到了干燥剂的作用,A选项符合题意。
3.(2010·龙岩模拟)亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂。当它们作还原剂时,生成的含氮产物可能是( )
A.NO B.N2 C.NO2 D.NH3
[解析]选C。当亚硝酸(HNO2)及其钠盐作还原剂时,氮元素的化合价只能升高,因此选C选项。
2.(2010·福建师大附中模拟)相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是( )
①铜片消耗完所需时间; ②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数; ④反应后溶液中铜离子的浓度
A.①③ B.②④ C.③④ D.只有①
[解析]选C。硝酸的浓度越大,反应速率越快,消耗时间越少;1mol Cu与足量的浓硝酸反应会生成2mol NO2, 1mol Cu与足量的稀硝酸反应会生成2/3 mol NO;参加反应的铜的质量相同,因此氧化剂得到的电子也相同;由于铜元素守恒,反应后溶液中铜离子的浓度也相同。
1.(2010·荆门模拟)13.8g 63%的HNO3溶液(密度为1.38g•cm-3)和100mL 13.8 mol/L的HNO3溶液相比,正确的是( )
A.都应用棕色广口瓶存储 B.浓度不同的两种HNO3溶液
C.溶液的体积不同但浓度相同 D.均可与Au反应而发生钝化现象
[解析]选C。浓硝酸应该盛放在棕色细口瓶中,因此A选项错误;前者根据公式c=1000ρw%/M可以计算出物质的量浓度为13.8 mol/L,因此两者浓度相同,B选项错误;C选项正确;浓硝酸不与Pt、Au反应,室温下浓硝酸能够使铁、铝钝化因此D选项错误。
16.(2010·福建模拟)聚苯乙烯可用于制备高频绝缘材料,由苯乙烯合成这种高聚物的化学方程式为 。苯乙烯在一定条件下存在如下图转化关系。
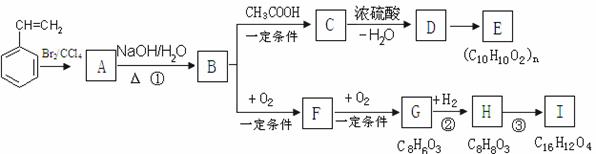
苯乙烯
|
请回答下列问题:
(1)反应①的反应类型是 。
(2)C可能的结构简式有 。
(3)H有多种同分异构体。符合下列条件的同分异构体共有 种。
① 与FeCl3溶液发生显色反应;
② 1 mol H最多能与3 mol NaOH反应;
③ 苯环上只有两个取代基。
(4)反应③的化学方程式是 。
[答案]

(1)水解反应(或取代反应)
(2) 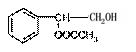
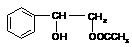
(3)3
(4)
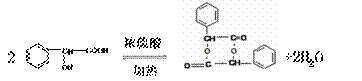
|

|
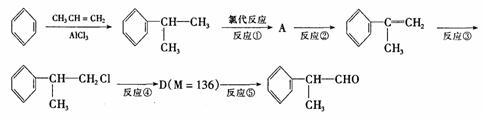
15.(2010·佛山模拟)氢化阿托醛 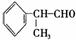 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被氧化后的含氧官能团的名称是 。
(2)在合成路线上②③的反应类型分别为② ③ 。
(3)反应④发生的条件是 。
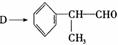
(4)由 反应的化学方程式为 。
(5)1mol氢化阿托醛最多可和______mol氢气加成,1mol氢化阿托醛发生银镜反应可生成__________molAg。
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式
为 。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫
色的同分异构体有 种。
[答案]
(1)羧基 (2)消去反应 加成反应 (3)NaOH水溶液加热
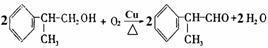
(4)
(5)4 ; 2 (6)CH3COOH ; 6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com