
题目列表(包括答案和解析)
3.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
2.人类历史上大量生产和使用铝、钛、铁、铜四种金属单质的时间顺序是( )
A.铜、铁、铝、钛
B.铁、铝、铜、钛
C.铜、铁、钛、铝
D.铁、铜、铝、钛
1.(2009年启东模拟)下列说法中不正确的是( )
A.人类历史上使用最早的合金是青铜
B.司母戊鼎是我国目前已发现的最重的青铜器
C.目前世界上使用量最大的合金是铝合金
D.目前世界上用途最广的合金是钢
12.(探究创新题)在电子工业中利用镁制取硅的反应为2Mg+SiO2 2MgO+Si,同时会发生副反应:
2MgO+Si,同时会发生副反应:
2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4
(硅烷),SiH4在常温下是一种不稳定、易自燃的气体。下图是进行Mg与SiO2反应的实验装置。试回答下列问题:
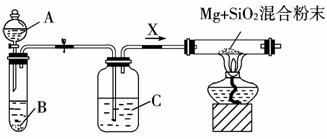
(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气。在A、B、C三种仪器中反应开始前的试剂分别是:A____________,B____________,C____________(填序号)。
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱
⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是____________ ;
当反应引发后,移走酒精灯,反应能继续进行,其原因是____________ 。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:
①____________ ,
②____________ 。
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如下流程进行提纯
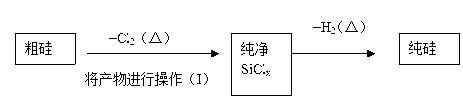
①操作(I)的名称是____________。
②涉及的化学反应方程式为:
____________ ;
11.(思维拓展题)如下图,已知:
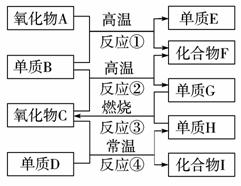
①单质E可作为半导体材料;
②化合物F为气体;
③化合物I溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)B一定是____________(填“金属”或“非金属”)元素,并说明理由____________ 。
(2)化合物F是____________。
(3)化合物I是____________。
(4)反应③的化学方程式是____________ 。
10.(2009年盐城模拟)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的是化合物G。
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:
①化合物G的化学式为____________,②1 mol NH3和0.75 mol E恰好完全反应生成G和HCl,则化合物E的分子式为______________。
(2)粉末状G能够与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃的主要原料。与氧反应所得的产物还有一种单质,与水反应生成另一种产物是该种单质元素的氢化物。请写出化合物G与水反应的化学方程式______________________。
(3)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在G中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表达为Si6-xAlxOxY8-x。在接近于1700 ℃时x的极限值约为4.0,在1400 ℃时x为2.0,以保持整个化合物呈电中性。试问:“赛伦”中Y元素的化合价为:____________。
9.(1)普通玻璃的化学式是Na2CaSi6O14,以氧化物形式可
表示为____________,钾云母的化学式是K2H4Al6Si6O14,以氧化物形式表示为____________。正长石的化学式是KAlSi3Ox,x是____________,以氧化物形式表示为____________。
(2)三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃
疡,是因为该物质不溶于水,服用后能中和胃酸,作用持
久。写出三硅酸镁与盐酸(胃酸中含有盐酸)反应的化学方程式:____________ 。
8.已知a是一种单质,在一定条件下可发生如下图所示的转化关系,则下列叙述中正确的是( )
A.a可能是铝或硅
B.向b中滴加少量盐酸可得到c
C.c是一种两性物质
D.d一定是共价化合物
7.(广州名师卷)以石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2C Si(粗)+2CO↑
Si(粗)+2CO↑
②Si(粗)+2Cl2 SiClx
SiClx
③SiClx+2H2 Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是( )
A.①③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移2 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
6.能证明碳酸比硅酸酸性强的实验事实是( )
A.CO2是气体,SiO2是固体
B.高温下能发生反应Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
C.CO2溶于水生成碳酸,而SiO2却不溶于水
D.CO2通入Na2SiO3溶液中有胶状沉淀生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com