
题目列表(包括答案和解析)
8.(2009年新疆模拟)某分子的球棍模型如右图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
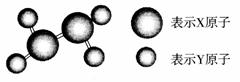
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,
又含氢键
D.从圆球的大小分析,该分子可能为N2F4
7.(2009年山东模拟)下列说法中,正确的是( )
A.Na2O2固体中阳离子和阴离子的个数比为2∶1
B.短周期元素X和Y的原子序数相差2,则X与Y既可能同周期,也可能同主族
C.若R2+和M-离子具有相同的电子层结构,则原子半径R<M
D.原子的L层电子数为偶数的元素均不能形成双原子分子单质
6.(2009年北京卷)甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是( )
A.某钠盐溶液含甲电离出的阴离子,
则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
5.(2009年泰安质检)下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl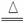 NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
4.(2009年昌乐质检)下列电子式正确的是( )
A.
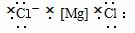
B.
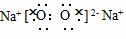
C.
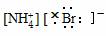
D.
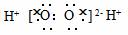
3.现有如下各说法:
①在水中氢、氧原子间均以化学键相结合;
②金属和非金属化合形成离子键;
③离子键是阳离子、阴离子的相互吸引;
④根据电离方程式HCl=H++Cl-,可判断HCl分子里存在离子键;
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确的是( )
A.①②⑤
B.都不正确
C.④
D.仅①不正确
2.(2009年韶关质检)下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O
B.BF3
C.CCl4
D.PCl5
1.(2010年威海质检)下列物质中含有相同的化学键类型的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
12.下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) mol·-1L |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,____________对反应速率有影响,____________反应速率越快,
能表明同一规律的实验还有____________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有- (填实验序号)。
(3)本实验中影响反应速率的其他因素还有____________,其实验序号是____________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:______________________________________ 。
11.甲、乙两位同学学习了化学反应与能量的有关知识后,进行了如下探究,请你参与其中的探究,并分析和解答相关问题。
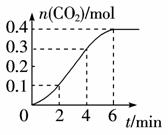
Ⅰ.甲同学为探究CaCO3与稀盐酸反应的化学反应速率,设计实验如下:在25 ℃时,将CaCO3放入1000 mL 1 mol·-1L稀盐酸中,根据得到CO2气体的物质的量随反应时间的变化情况,绘制成如右图所示的曲线。根据曲线分析讨论以下问题(假设溶液的体积变化忽略不计)。
(1)在0~2 min、2 min~4 min、4 min~6 min内,反应速率最大的是____________,原因是____________ 。该反应是____________(填“吸热”或“放热”)反应。
(2)在0~4 min内,用HCl表示的平均反应速率为____________。
(3)6 min以后反应速率为____________,原因是____________ 。
Ⅱ.乙同学探究KClO3和NaHSO3溶液反应,查阅资料知:
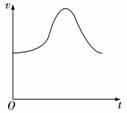
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价),在某温度下,他绘出大致的反应速率随时间变化如右图所示。已知该反应速率随着溶液中c(H+)增大而加快。
(1)反应开始反应速率加快的原因是____________ ____________ 。
(2)反应后期反应速率下降的原因是____________ ____________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com