
题目列表(包括答案和解析)
3.强酸与强碱的稀溶液发生中和反应:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ·mo-1L分别向1 L 0.5 mol·-1L的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3
B.ΔH2<ΔH1<ΔH3
C.ΔH1=ΔH2=ΔH3
D.ΔH1>ΔH3>ΔH2
2.环境是人类生存和活动的场所。下列有关人类满足生活和生产活动需求做法的说法中,不正确的是( )
A.第29届奥运会的火炬燃料丙烷燃烧产物为二氧化碳和水,符合中国政府办一个“绿色奥运”的承诺
B.“长征”系列火箭为我国的航天事业立下了汗马功劳,其推进剂(偏二甲肼/四氧化二氮)属于环保燃料
C.2007年在太湖发生的蓝藻“水华”现象是该区域的生活污水、工业废水等造成水域富营养化的结果
D.研究人员用植物碳水化合物制造出了柴油燃料,属清洁的可再生能源
1.下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸铵受热分解
B.乙烷燃烧
C.铝粉与硫酸反应
D.氧化钠溶于水
12.(2009年枣庄质检)将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
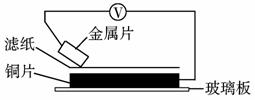
|
金属 |
电流方向 |
电压(V) |
|
A |
Cu→A/ |
+0.78 |
|
B |
B→Cu |
-0.15 |
|
C |
Cu→C |
+1.35 |
|
D |
Cu→D |
+0.30 |
已知:构成两电极的金属活动性相差越大,电压表的读数越大。请依据表中数据判断:
(1)____________金属可能是最强的还原剂。
(2)____________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是____________(填字母)。金属对应的原电池的电极反应为:
负极:______________,
11.某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:
有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为-__________________________________________________________________________________________ 。
方案Ⅱ:
有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式:____________ ;
负极反应式:____________ 。
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):____________ ____________ ,
用离子方程式表示其反应原理:____________ 。
10.ZPower电池使用锌聚合物作为阳极、银纳米颗粒作为阴极,其安全性类似于传统的碱性电池,并且其材料95%可回收,该电池的容量比同体积的锂电池高30%。银锌电池广泛用作各种电子仪器的电源,它的充、放电过程可表示为2Ag+Zn(OH)2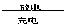 Ag2O+Zn+H2O。
Ag2O+Zn+H2O。
根据上述信息回答下列问题:
(1)电池在放电时,作为负极的是____________,电极反应式为______________;正极电极反应式为____________ 。
(2)该电池属于____________性电池(填“酸”、“碱”或“中”)。
(3)写出充电时的反应式:
阳极:____________ ;
阴极:____________ 。
3.84 g,则该原电池的工作效率是____________(指参加原电池反应的锌占反应总量的百分率)。
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌失去的电子不能持续通过导线流向铜极给Cu2+?____________。
(3)实验三中盐桥中的K+流向____________溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3 mol/s,则K+的迁移速率为____________ mol/s。与实验一比较,实验三原电池的工作效率大大提高,原因是____________ 。
(4)你根据实验一、二、三可得出的结论是____________ ____________(写出两点即可)。
9.某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验,请分析实验结果后回答相应问题。
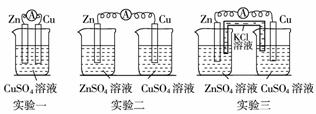
(1)实验一中铜片、锌片表面均有红色物质析出,电流
计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94 g,铜片增重了
8.(2009年淄博质检)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
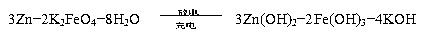
下列叙述不正确的是( )
A.放电时负极反应为:Zn+2OH-=Zn(OH)2+2e-
B.充电时阳极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
7.某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴甲基橙试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象不可能出现的是( )
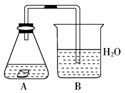
A.B中导气管中产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com