
题目列表(包括答案和解析)
12.某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO2-3+H2O=2Fe2++SO2-4+2H+;
二是发生双水解反应:2Fe3++3SO2-3+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是________________。
实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是__________________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_________ __________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 _______________________________________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。由上述实验得出的结论是__________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是_____ _______。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
11.某一反应体系有反应物和生成物共五种物质:O2 、H2CrO4 、Cr(OH)3 、H2O 、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
⑴ 该反应中的还原剂是___________________。
⑵ 该反应中,发生还原反应的过程是____________ → ________________。
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目
_______________________________________________________。
⑷ 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_______________。
10.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx 与NaClO的物质的量之比为1:16,则X的值是 ( )
A.2 B.3 C.4 D.5
9.一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO42-。现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是( )
A.被还原的硝酸为0.16mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1 D.CuS未全部参加反应
8.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1 molAg,下列结论错误的是( )
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+物质的量比为1:2
D.1 mol Fe可还原2 molFe3+
7.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成: Al2O3
+ N2 + 3C 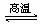 2AlN + 3CO,下列叙述正确的是
( )
2AlN + 3CO,下列叙述正确的是
( )
A.氮化铝晶体属于分子晶体
B.氮化铝中氮元素的化合价为-3
C.上述反应中每生成2molAlN,N2得到3mol电子
D.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
6.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为aHClO3===bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O==12H++10Cl-+2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:
26HClO3 ====15O2↑+8C12↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
5.铜的冶炼大致可分为:
⑴富集,将硫化物矿进行浮选;⑵焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);⑶制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 ==2Cu2O+2SO2;2Cu2O+ Cu2S==6 Cu+SO2↑;⑷电解精炼。下列说法正确的是 ( )
A.上述灼烧过程的尾气均可直接排空
B.由6mol CuFeS2生成6molCu,上述共消耗15molO2
C.在反应2Cu2O+ Cu2S==6 Cu+SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
4.CS2是一种有恶臭的液体,它滴入用H2SO4酸化的KMnO4溶液时,有黄色沉淀析出,并放出CO2气体,当产生0.5molCO2时,转移的电子数目是 ( )
A.NA B.2NA C.3NA D.4NA
3.某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是 ( )
A.KMnO4 B.Na2CO3 C.(NH4)2SO4 D.CH3COOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com