
题目列表(包括答案和解析)
4.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.NaOH
B.H2SO4
C.AgNO3
D.Na2SO4
3.(2010年郑州质检)用如下图所示装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
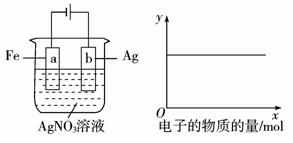 ①c(Ag+) ②c(NO3-)
①c(Ag+) ②c(NO3-)
③a棒的质量 ④b棒的质量
⑤溶液的pH
A.①③
B.③④
C.①②④
D.①②⑤
2.(2009年青岛月考)利用如右图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色。下列说法错误的是( )
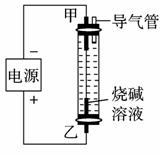
A.烧碱溶液注入容器前,需预先煮沸
B.甲电极上有氢气冒出
C.只能用铁作甲电极和乙电极
D.可用食盐水代替烧碱溶液
1.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作为阳极
B.电解法精炼粗铜,用纯铜作为阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作为阴极
D.在镀件上电镀锌,用锌作为阳极
12.下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系,请回答下列问题:
|
pH |
[CrO42-] |
[HCrO4-] |
[Cr2O72-] |
[H2CrO4] |
|
4 |
0.0003 |
0.104 |
0.448 |
0 |
|
5 |
0.0033 |
0.103 |
0.447 |
0 |
|
6 |
0.0319 |
0.0999 |
0.437 |
0 |
|
7 |
0.2745 |
0.086 |
0.3195 |
0 |
|
8 |
0.902 |
0.0282 |
0.0347 |
0 |
|
9 |
0.996 |
0.0031 |
0.0004 |
0 |
(1)写出铬酸电离反应方程式:____________ ____________ 。
(2)若要得到CrO42-应控制的条件是____________ 。
(3)铬酸(H2CrO4)溶液中,电离出CrO42-的电离平衡常数为K2,电离出Cr2O72-的电离平衡常数为K3,则K2__________K3(填“>”、“=”或“<”)。
(4)铬酸的物质的量浓度为____________(精确到小数点后两位)。
11.(2008年山东卷)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。(1)丙烷脱氢可得丙烯。已知:
C3H8(g)= CH4(g)+HC≡CH(g)+H2(g);
ΔH1=156.6 kJ·mo-1L
CH3CH= CH2(g)=CH4(g)+HC≡CH(g);
ΔH2=32.4 kJ·mo-1L
则相同条件下,反应C3H8(g)= CH3CH=CH2(g)+H2(g)的ΔH=____________kJ·mo-1L。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为____________;放电时,CO32-移向电池的____________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=560,c(H2CO3)=1.5×10-5 mol·-1L。若忽略水的电离及H2CO3的第二级电离,则H2CO3=HCO3-+H+的平衡常数K1=____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·-1L NaHCO3溶液的pH大于8,则溶液中c(H2CO3)____________c(CO32-)(填“>”“=”或“<”),原因是______________(用离子方程式和必要的文字说明)。
10.(2009年济南一模)请你协助化学兴趣小组的同学完成如下实验,并回答相关问题。实验目的:比较等体积0.5 mol/L硫酸、1 mol/L盐酸、1 mol/L醋酸分别与金属反应生成氢气的速率和体积。实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由)。选择的金属是____________,不选其他两种金属的理由是____________ 。
实验步骤:
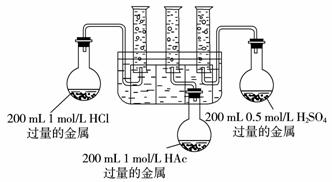
(1)甲同学设计的实验装置如上图所示。
(2)乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进。你认为乙同学改进的措施是:____________ ____________ 。
(3)按改进后的装置进行实验,观察现象并得出相关结论。实验现象及结论:____________
____________ 。
(4)反应开始时的速率:v(H2SO4)____________v(HCl)____________v(HAc)(用“=”、“<”或“>”填空,下同),反应进行一段时间后的速率:v(H2SO4)<v(HCl)____________v(HAc)。
(5)最终得到的氢气体积:V(H2/H2SO4)____________V(H2/HCl)____________V(H2/HAc)。
问题讨论:
(6)对结论“(4)”、“(5)”中盐酸和醋酸的异同,你的解释是____________ 。
9.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25 ℃时有HA=H++A-,则K=c(H+)·c(A-)/c(HA)式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃):
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH=CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3=H++HCO3-
HCO3-=H++CO32- |
K1=4.31×10-7 K2=5.61×10-10 |
|
H2S |
H2S=H++HS HS-=H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
|
H3PO4 |
H3PO4=H++H2PO4-
H2PO4-=H++HPO42- HPO2-4=H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值____________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?____________ 。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是____________,最弱的是____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是______________,产生此规律的原因是____________ ____________ 。
8.下列实验事实不能证明醋酸是弱酸的是( )
A.常温下,醋酸溶液能与石灰石反应生成CO2
B.常温下,测得0.1 mol·-1L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
7.对氨水溶液中存在的电离平衡NH3·H2O=NH4++OH-,下列叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com