
题目列表(包括答案和解析)
8、(多选)(2010·中山模拟)能证明某溶液中含有Fe2+的是( )
A.该溶液呈浅绿色
B.该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色
C.向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色
D.向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色
[解析]选BD。A中如果含有其他离子如铬酸氯也显示出浅绿色;C中如有Fe3+即可推翻;
B、D两个选项是Fe2+的特征反应。
7、(2010·郑州模拟)碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是 ( )
A.35g B.30 g C.20 g D.15 g
[解析]选C。本题的关键在于利用守恒思想。混合物溶于盐酸后溶质成分是CuCl2,根据氯守恒可得
n(Cu)=0.25 mol,所以m(CuO)=0.25x80g=20g。
6、(2010·山西山大附中模拟)所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
|
|
Na |
Cu |
Al |
Fe |
|
熔点 |
97.5℃ |
1083℃ |
660℃ |
1535℃ |
|
沸点 |
883℃ |
2595℃ |
2200℃ |
3000℃ |
其中不能形成合金的是 ( )
A.Cu和Na B.Fe与Cu C.Fe与Al D.Al与Na
[解析]选A。合金形成的条件是由共同的融化状态,所以看两种金属的熔沸点的范围;A中钠达到沸点时Cu还没熔化所以不能形成合金;而其他三项均可。
5、(2010·重庆一中模拟)常温条件下,相同的钠粒在30mL硫酸铜溶液中比在20mL纯水中反应更剧烈,
分析其原因,下列说法中最合理的是 ( )
A.Cu2+的氧化性比H+的强
B.硫酸铜溶液中的c(H+)比水中的大
C.硫酸铜溶液的体积比水的大
D.硫酸铜溶液中的SO42-更易与生成的Na+结合
[解析]选B。由题意可知,钠反应的原理主要决定于c(H+),因此B选项更趋向合理;A、C、D均
不合理。
4、(2010·南开中学模拟)A-D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水合物。那么A不可能是( )

A. S B. Si C. Al D. Fe
[解析]选D。由题意可知,D选项中,Fe(OH)3不能转化为Fe3O4,所以选D项。
3、(2010·长沙模拟)某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为 ( )
A.5.6 g B.11.2g C.22.4g D.33.6g
[解析]选C。
2、(2010·哈尔滨模拟)某10mL溶液中HNO3浓度为2mol/L 、H2SO4浓度为4mol/L,现在加入56g铁粉,充分反应,产生的气体在标准状况下的体积为 ( )
A.0.448L B.4.48L C.0.672L D.0.896L
[解析]选C。根据题意可知n(H+)=0.1 mol、n(NO3-)=0.02 mol、n(Fe)=1 mol,
由氧化还原原理可知Fe先与 HNO3与反应,铁过量,硝酸全部转化为NO 0.02 mol ,根据反应的量化关系剩余0.02 mol的H+故产生的氢气为0.1 mol气体在标准状况下的总体积为0.672L。
1、(2010·南开中学模拟)已知2Fe2++Br2=2Fe3++2Br-。向100mlFeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2mol/L B. 1mol/L C. 0.4mol/L D. 0.2mol/L
[解析]选A。利用原子守恒及电子守恒原理,可知2/3的Cl2与Fe2+反应,即
n(Fe2+)= 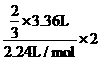 =0.2mol,所以c(FeBr2)=2mol/L。
=0.2mol,所以c(FeBr2)=2mol/L。
15、(2010·成都模拟)某核素R原子核内中子数比质子数多43,由它组成的固体单质A,在一定条件下密度为6.88g·cm-3,用X射线研究其固体表明,在边长为1.0×10-7cm3的立方体中含有20个原子。R的+4价化合物在溶液中具有强氧化性,可将NO2氧化为HNO3。请回答:
(1)R原子的摩尔质量为 (取整数)。
(2)R元素的核电荷数为 ,处于周期表中第 周期 族,其元素符号为 。
(3)溶液中不存在R4+,假若能使少量R4+加到FeCl2溶液中,是否会发生反应?
若“否”,其原因为: 。(若“是”,则不答)
若“是”,其离子反应方程式为: 。(若“否”,则不答)
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。已知R3O4与足量的HNO3反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的离子方程式为:
[答案](1)207g/mol (2)82 6 ⅣA Pb
(3)Pb4++2Fe2+= Pb2++2Fe3+ (4)Pb3O4+4H+=PbO2+2Pb2++2H2O
14、(2010·上海徐汇区模拟)已知20℃时,CO2密度为1.83g/L,Ca(OH)2的溶解度为0.165g/100g H2O。20℃时,将NaOH和Ca(OH)2的混合物2.02 g全部溶于897g水中配制成稀溶液,再缓缓通入CO2气体(不考虑溶解过程中溶质之间溶解性的相互影响)。
计算:(计算结果精确到0.01)
(1)20℃时,CO2的气体摩尔体积为____________________L/mol;
(2)若消耗369mL CO2气体时,生成沉淀的质量刚好达到最大,求原混合物中NaOH的质量。
(3)若在上述溶液中缓缓通入CO2气体,使其充分反应,理论上消耗CO2的总体积为VmL,则V的取值范围为 。
[答案](1)24.04; (2)1.28g
(3)1214.02<V<1286.14
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com