
题目列表(包括答案和解析)
22.(2010·锦州模拟)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有______种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为______(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是___________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为_______________、________________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________________。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为______________________________。
[解析]酚酞试液呈粉红色,说明试管A溶液中含有OH-,则没有能够和OH-结合成沉淀的离子,所以Ag+、Mg2+不存在,它们一定在试管B中,根据电荷守恒,则必定存在K+;Cl-能够和Ag+结合成AgCl沉淀,在B中不含Cl-,根据电荷守恒,B中所含的阴离子一定是NO3-。综上所述,A中含有K+、Cl-和OH-三种离子,B中含有Ag+、Mg2+和NO3-三种离子。然后结合题目要求即得答案。
[答案](1)3 (2)B (3)Mg
(4)Ag+ +Cl-=AgCl↓、Mg2++2OH-=Mg(OH)2↓
(5)n (K+)︰n (Mg2+)︰n (NO3-)=4︰1︰6
(6)Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
21.(2010·沈阳模拟)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、
SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是____________________________________,肯定不存在的离子是___________________________。
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O ②__________________
③__________________ ④HCO3-+H+=H2O+CO2↑
⑤__________________
[解析]强碱性溶液中一定不含Al3+、NH4+。取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成,说明溶液中肯定不存在SO42-、SiO32-;根据实验②可以判断溶液中一定有AlO2-和CO32-,发生的反应依次为H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑、Al(OH)3+3H+=Al3++3H2O;所以溶液中一定存在OH-、AlO2-、CO32-和K+,一定不存在Al3+、NH4+、SO42-、
SiO32-。若原溶液中没有Cl-,加入足量的硝酸银溶液可得到沉淀的质量为0.005L×0.2mol/×143.5g /mol=0.1435g<0.187g,所以原溶液中含有Cl-。
[答案](1)OH-、AlO2-、CO32-、K+ Al3+、NH4+、SO42-、SiO32-
(2)含有Cl-
(3)②AlO2-+H++H2O=Al(OH)3↓ ③CO32-+H+=HCO3-
⑤Al(OH)3+3H+=Al3++3H2O
20.(2010·保定模拟)某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1,则X可能为( )。
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
[解析]选B。SO42-和Ba2+能够反应生成BaSO4沉淀,在酸性条件下NO3-能够将Fe2+氧化成Fe3+,所以溶液中一定没有Ba2+和Fe2+。假设题中所给的离子的物质的量依次为2mol、3mol、1mol、3mol和1mol,阳离子所带的正电荷数为:n(正电荷)=3n(Fe3+)+n(H+)=3×1mol+1×3mol=6mol,阴离子所带的负电荷数为:n(负电荷)=n(NO3-)+
2n(SO42-)=1×2mol+2×3mol=8mol,所以还缺少2mol正电荷,因为n(X)=1mol,所以X带两个正电荷,为Mg2+。
19.(2010·潍坊模拟)某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液可能大量存在的一组离子是( )。
A.K+、H+、NO3-、Na+ B.H+、Br-、SO42-、Na+
C.SO42-、Br-、OH-、Fe3+ D.H+、Br-、SO32-、K+
[解析]选B。A项中加入BaCl2不产生沉淀;C项中因Fe3+呈棕黄色,溶液不是无色的;D项中H+和SO32-不能大量共存,故选B。
18.(2010·威海模拟)有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、
HCO3-、MnO4-中的一种或几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体并产生白色沉淀再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )。
A.肯定有K+、HCO3-、MnO4-
B.肯定有Al3+、Mg2+、HCO3-
C.肯定有Al3+、Mg2+、SO42-
D.肯定有Al3+、Mg2+、NH4+、Cl-
[解析]选C。首先由“无色”溶液,否定MnO4-的存在;再由“加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解”,可判断原溶液含Mg2+、Al3+,因为Al(OH)3溶于过量碱而Mg(OH)2不溶;又根据“加入酸化的Ba(NO3)2溶液,有白色沉淀产生”,可判断该沉淀是BaSO4,原溶液中含
SO42-,综合分析结果可知,溶液中肯定有Mg2+、Al3+、SO42-,故选C。
17.(2010·南京模拟)某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )。
A.Cl-、Mg2+、H+、Zn2+、SO42- B.Na+、Ba2+、NO3-、OH-、SO42-
C.K+、NO3-、SO42-、OH-、Na+ D.MnO4-、K+、Cl-、H+、SO42-
[解析]选AC。A项中的离子能共存,且H+能与HCO3-反应生成气体;B中的Ba2+与SO42-不能共存;C项中离子间能共存且OH-能与NH4+反应生成气体;D中的
MnO4-是一种紫色的离子,不合题意,所以正确答案为AC。
16.(2010·镇江模拟)在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )。
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN-
B.pH为1的溶液:Cu2+、Na+、Al3+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Mg2+
[解析]选B。A中Fe3+与SCN-不共存;C中“水电离出来的c(H+)=10-13mol/L的溶液可能为酸,可能为碱,而无论在酸中还是碱中HCO3-都不可共存,D中Mg2+与CO32-不共存。
15.(2010·上海浦东区模拟)下列离子方程式书写正确的是( )。
A.NaHSO3溶液显弱酸性是因为:HSO3-+H2O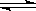 SO32-+H3O+
SO32-+H3O+
B.尼泊金酸(HO- COOH)与碳酸氢钠溶液反应:
COOH)与碳酸氢钠溶液反应:
 HO-
HO- COOH +2HCO3-→-O-
COOH +2HCO3-→-O- COO-+2CO2↑+2H2O
COO-+2CO2↑+2H2O
C.电解氯化镁溶液时电极反应的离子方程式是:2Cl-+2H2O====Cl2↑+H2↑+2OH-
D.1L 2mol/L的FeBr2溶液中通入2.5mol Cl2:
2Fe2++8Br-+5Cl2====10Cl-+2Fe3++4Br2
[解析]选A。B项羧基酸性比碳酸强,酚羟基酸性比碳酸弱,故酚羟基不能发生反应;C项应该生成Mg(OH)2沉淀;D项Fe2+还原性比Br-强,正确的离子反应式为4Fe2++6Br-+5Cl2=10Cl-+4Fe3++3Br2。
14.(2010·淮安模拟)下列离子方程式书写不正确的是( )。
A.少量铁粉加入稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
B.Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+
CO32-+2H2O
D.Na2S溶液中通入足量H2S:S2-+H2S=2HS-
[解析]选AC。A项少量铁粉被稀硝酸氧化成Fe3+;C项反应的离子方程式为
NH4++HCO3-+2OH-+Ba2+=BaCO3↓+2H2O+NH3↑。
13.(2010·九江模拟)下列反应的离子方程式正确的是( )。
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O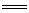 AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B.用小苏打治疗胃酸过多:HCO3-+H+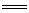 CO2↑+H2O
CO2↑+H2O
C.把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3-+Ca2++OH-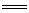 CaCO3↓+H2O
CaCO3↓+H2O
D.如将少量SO2通入漂白粉溶液中:H2O+SO2+Ca2++2ClO-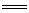 CaSO3↓+2HClO
CaSO3↓+2HClO
[解析]选B。分析选项A时,应该注意到Al(OH)3不能溶于过量氨水,故此选项不正确;C项错在未考虑反应物中量的关系。应为:2HCO3-+Ca2++2OH-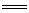 CaCO3↓+2H2O+CO32-;D项错在忽略了HClO可以将+4价的硫氧化,应为:H2O+SO2+Ca2++ClO-
CaCO3↓+2H2O+CO32-;D项错在忽略了HClO可以将+4价的硫氧化,应为:H2O+SO2+Ca2++ClO-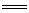 CaSO4↓+2H++Cl-;只有B项正确。
CaSO4↓+2H++Cl-;只有B项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com