
题目列表(包括答案和解析)
18.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下所示的转化关系。
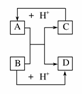
(1)如果A、B、C、D均是10电子的微粒,请写出:A的结构式________;D的电子式________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式_______________________________________。
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
(3)已知肼(H2N-NH2)和甲胺(CH3-NH2)都是18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):________。
解析:(1)观察框图,容易想到NH+OH-NH3+H2O或HF+OH-===F-+H2O反应。
(2)①18电子微粒很多,酸碱中和是容易想到的:H2S+OH-===HS-+H2O或HS-+OH-===S2-+H2O。②联想强酸制弱酸的道理,可得到强碱制弱碱,结合质子的能力显然B>C。
(3)按C、H、O、F替换即可。
答案:(1) 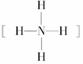 或H-F H∶····∶H
或H-F H∶····∶H
(2)①H2S+OH-===HS-+H2O或HS-+OH-===S2-+H2O ②OH- S2-(或HS-)
(3)CH3-CH3,CH3-OH,CH3-F
17.(2009·江苏)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
解析:据“X的原子半径最小”可知X为H元素;据“Y原子最外层电子数是次外层电子数的3倍”可知Y原子结构示意图为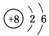 ,即Y为O元素,R与Y同一主族且属短周期元素,所以R是S元素;Z、W两元素与R同周期,且Z、W原子的核外电子数之和等于8+16=24,所以Z只能为11号元素Na,W只能为13号元素Al。A项中O2-、Na+、Al3+的离子半径依次减小;B项中H元素与O元素可以形成化合物H2O2;C项中氢化物的热稳定性H2O>H2S;D项中W对应的Al(OH)3为两性氢氧化物。
,即Y为O元素,R与Y同一主族且属短周期元素,所以R是S元素;Z、W两元素与R同周期,且Z、W原子的核外电子数之和等于8+16=24,所以Z只能为11号元素Na,W只能为13号元素Al。A项中O2-、Na+、Al3+的离子半径依次减小;B项中H元素与O元素可以形成化合物H2O2;C项中氢化物的热稳定性H2O>H2S;D项中W对应的Al(OH)3为两性氢氧化物。
答案:C
16.(2009·北京)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7?17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是 ( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
解析:W为氯元素(Cl),X为氟元素(F),Y为铝元素(Al),Z为钠元素(Na),则B项:因HF分子间有氢键,沸点HF>HCl,D项:原子半径符合,而离子半径应为F->Na+>Al3+。
答案:B
15.(2009·山东)元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是 ( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
解析:A项如碘元素可形成FeI2(非金属性)、I(NO3)3(金属性),C项如Li+、Be2+为2电子。
答案:B
14.(江苏省扬州中学2008-2009学年度第二学期月考)原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为KXO3的含氧酸钾盐
C.X原子最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
解析:若n=1,则最外层电子数为3,不存在;若n=2,则最外层电子数为5,质子数为7,符合2n2-1的即为氮元素;若n=3,最外层电子数为7,质子数为17,符合2n2-1的即为氯元素。所以X为氮元素或者氯元素,A项错误;X能形成KNO3或者KClO3,B项正确;从上述分析可知,C项正确;N、Cl都能与金属单质反应,如3Mg+N2===Mg3N2、Mg+Cl2===MgCl2,D项正确。
答案:A
13.(2008·广东梅州3月)下列各组物质的性质比较,正确的是 ( )
A.酸性:HClO4>H3PO4>H2SO4
B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.氧化性:F2>Cl2>Br2>I2
解析:A项应为HClO4>H2SO4>H3PO4;B项应为HF>H2O>H2S;C项应为NaOH>Ca(OH)2>Mg(OH)2。
答案:D
12.(2009·皖南八校高三第一次联考)Y元素的最高正价与最低负价的绝对值之差是4;Y元素可与M元素形成离子化合物,并在水中电离出电子层结构相同的阴、阳离子,则该化合物是 ( )
A.K2S B.Na2S
C.Na2O D.KCl
解析:S元素的最高正价是+6,最低负价是-2,绝对值之差是4,与S2-电子层结构相同的是K+。
答案:A
11.(2008·广东理基)根据下表信息,判断以下叙述正确的是 ( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
解析:本题是一个表格信息题,解决这类问题的关键在于:反复对比数据,结合所学知识,做出判断并进行验证。因讨论的元素为短周期元素,L、Q均+2价,L原子半径大于Q原子半径,所以L为Mg,Q为Be;M显+3价,原子半径较略小,所以M为Al;R、T均有-2价,R还有+6价,且R原子半径大于T原子半径,所以R为S元素,T为氧元素。H2O>H2S(沸点),由于水分子间存在氢键;L、Q单质与盐酸反应速率L>Q(即Mg>Be);M、T形成的是Al2O3,具有两性;L2+(Mg2+)与R2-(S2-)的核外电子数不相等。
答案:C
10.(2008·广东化学)元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是 ( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
解析:根据题意,符合条件的化合物有NaNO3和MgCO3两种。B项中MgCO3微溶于水,MgO为离子化合物。
答案:B
9.目前人类已发现的110多种元素中,除22种非金属元素外,大多数为金属元素,下列对金属元素与非金属元素的相关判断中正确的是 ( )
A.金属元素的阳离子被还原一定得到对应的单质
B.非金属性越强的元素,其气态氢化物越稳定
C.同主族元素的单质其熔点随着原子序数的增加而升高
D.金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com