
题目列表(包括答案和解析)
10、(2010·南开中学模拟)下列叙述正确的是( )
A.用两支惰性电极电解硫酸铜溶液,当有1´10-3molOH-放电时,阴极上析出标况下氢气11.2mL
B.能使甲基橙显红色的溶液中可以大量存在Fe2+、Cl-、NO3-、Na+、SO42-离子
C.将固体Si放入NaOH溶液中所发生反应的离子方程式为:Si + 2OH- + H2O=SiO32- + 2H2
D.碳酸钠溶液显碱性的原因为:CO32- + H2O = HCO3- + OH-
[解析]选C。A项,惰性电极电解硫酸铜溶液,阴极上析出铜不是氢气;B项,能使甲基橙显红色的溶液显酸性,酸性条件下NO3-具有强氧化性,Fe2+不能大量存在;D项CO32-水解方程式书写错误。
11、(2010·南开中学模拟)2008年北京举行奥运会时,北京市区90%的公交车和70%的出租车将使用清洁燃料,为全球奥运选手和北京市民提供舒适、快捷、清洁的交通服务。上海将使用1000辆以上清洁汽车和电动汽车,包括20-30辆燃料电池车。通常用的清洁燃料是指压缩天燃气和液化石油气。下列有关说法不正确的是( )
①压缩天燃气和液化石油气都属于碳氢化合物
②使用清洁能源主要是考虑防止沙尘暴
③电动汽车和氢燃料电池车可实现污染物的“零排放”
④用固体氧化物陶瓷做电解质(传递O2-)的燃料电池车,正极发生的电极反应为:H2+O2--2e-=H2O
A.①② B.②③ C.③④ D.②④
[解析]选D。天燃气主要成分是CH4,液化石油气主要成分是丁烷,都属于碳氢化合物;使用清洁能源主要是减少大气污染;燃料电池车的正极发生还原反应,电极反应为:O2+ 4e-= 2O2-。
9、(2010·南开中学模拟)液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池。正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液。下列有关说法不正确的是( )
A.将LiCoO2改写为氧化物的形式为Li2O·Co2O3
B.该电池的电解液使用有机溶剂的原因是有机溶剂有良好的导电性
C.Li是第3号元素,是地球上最轻的金属,该电池具有比较好的质能比
D.在电池放电时,Li+在两个电极之间往返嵌入和脱嵌。该电池的充放电反应方程式:

LiCoO2+6C Li1-xCoO2+LixC6。
[解析]选B。使用有机溶剂是为了防止有H+对电极反应造成影响。
8、(2010·延边模拟)据报道,我国拥有完全自主产权的氢氧燃料电池车已经在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是( )
A.负极反应式为:2H2+4OH--4e- == 4H2O
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2 == 2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
[解析]选D。氢氧燃料电池负极反应物为H2,电解液为KOH,所以负极产物为H2O;氢氧燃料电池的总反应为2H2+O2 == 2H2O,KOH的物质的量不变;2.24LCl2的物质的量为0.1mol,有0.2mol电子转移.
7、(2010·河池模拟)如图所示,U形管中装入含有紫色石蕊的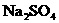 试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:( )
试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:( )


A.蓝、紫、红 B.红、蓝、紫
C.红、紫、蓝 D.蓝、红、紫
[解析]选C。惰性电极电解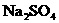 溶液,阳极产生氧气,阳极附近溶液显酸性,呈红色,阴极产生氢气,阴极附近溶液显碱性,呈蓝色,U形管中间溶液呈中性,显紫色。
溶液,阳极产生氧气,阳极附近溶液显酸性,呈红色,阴极产生氢气,阴极附近溶液显碱性,呈蓝色,U形管中间溶液呈中性,显紫色。
6、(2010·龙岩模拟)TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。答: 。
II、TiO2可通过下述两种方法制备金属钛:
方法一是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s) +
2Cl2 (g)  TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s) + O2 (g) = CO2 (g) △H = - 394 kJ·mol-1。
则TiO2 (s) + C (s) +2Cl2 (g) = TiCl4 (l) + CO2 (g)的△H = ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:_________________________________________________
[解析](1)FeO在第二步反应中可以与H2SO4反应生成FeSO4,所以第一步净化不需要除去。
(2)需要除去Al2O3和SiO2,这两者均和NaOH发生反应
(3)阴极为得电子反应TiO2+4e-=Ti+2O2-
(4)阳极生成氧气,会与阳极碳块发生反应,使阳极碳块不断减小。
[答案](1)不需要
(2)Al2O3+2NaOH=2NaAl O2+H2O
SiO2+2NaOH=Na2SiO3+H2O
(3)TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti)
(4)碳单质会与阳极产生的氧气反应而不断减少
(5)-243kJ ·mol-1
(6)碳单质与氧气反应,减小产物浓度,使平衡向右移动,导致反应顺利进行
5、(2010·南开中学模拟)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
 ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是( )
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
[解析]选A。A项,步骤⑴中H2SO4既不是氧化剂又不是还原剂;B项,步骤⑴中每析出1mol S 转移2mol电子,12.8g S的物质的量为0.4mol,共转移0.8mol电子;C项,MnO2是氧化产物,在阳极处产生;D项,步骤⑴中消耗硫酸而步骤⑶中产生硫酸,硫酸在生产中可循环使用。
4、(2010·天津宝坻区模拟)下列说法错误的是( )
[解析]选B。A项,钢铁发生吸氧腐蚀时,正极反应为2H2O+O2+4e-===4OH-;B项,表示H2燃烧热时,应是H2生成稳定化合物液态H2O的热化学方程式;C项,同一物质固、液、气三种状态的熵值依次增大;D项,AgCl饱和溶液中Ag+、Cl-的物质的量浓度为1.92×10-3÷108 mol· L-1=1.8×
10-5 mol · L-1,AgCl的Ksp=3.24×10-10。
3、(2010·许昌模拟)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极,浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________
[解析]根据题意,F元素的最外层电子数是次外层电子数的0.75倍,即F元素次外层8个电子,最外层6个电子,所以为S元素;根据C和F为同一主族,所以C为O元素。B元素最外层是内层电子数的2倍,即可能为C元素或Si元素,但A、B、C、D、E、F的原子序数依次增大,所以B为C元素;E元素的最外层电子数等于其电子层数,且原子序数大于O元素,所以E为Al元素;根据A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,即A+16+2=D+8,所以D-A=10,A、D同主族,所以A为H元素,D为Na元素。
(1)Al2S3+8NaOH=2Na[Al(OH)4]+3Na2S,所以消耗NaOH8mol;(2)中两种离子为OH-和HS-离子;
(3)C(s)+O2(g)=CO2(g), △H=-a KJ/mol,CO(g)+1/2O2(g)=CO2(g), △H=-2bKJ/mol;两式相减可得C(s)+
1/2O2(g)=CO(g);△H=-(a-2b)kJ/mol(4)反应方程式为H2O+CO=CO2+H2,属于恒温恒容且△Vg=0的反应。
[答案](1)8mol (2)HS-+OH-=S2-+H2O
(3)C(s)+1/2O2(g)=CO(g);△H=-(a-2b)kJ/mol(其他合理答案也可)
(4)AB
(5)Al-3e-+4OH-→AlO2-+2H2O
2、(2010·许昌模拟)北京大学教授,著名的化学家和教育家徐光宪教授,是我国理论化学和稀土化学的奠基人之一,2008年获得“国家最高科学技术奖”,以表彰他在稀土理论方面作出的贡献.稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应并产生气体.已知:铈常见的化合价为+3和+4,且Ce4++Fe2+=Ce3++Fe3+.下列说法正确的是( )
A.用Pt作阴极,Fe作阳极,电解熔融CeO2,可在阳极获得铈
B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中,其离子方程式为:
Ce4++Fe2+=Ce3++Fe3+
C.金属铈着火,可采用普通的泡沫灭火器灭火
D.金属铈可浸于煤油中保存,储存在阴凉、通风的地方,要远离火种和热源
[解析]选D。A项,Fe作阳极,阳极Fe被氧化成Fe2+后又发生反应Ce4++Fe2+=Ce3++Fe3+,不能得到铈;B项, I-还原性比Fe2+强,除Fe2+被氧化外,I-可被Ce4+氧化成I2 ;C项,铈可与水很快反应并产生气体,着火不可用普通的泡沫灭火器灭火;D项,铈在空气中易氧化,受热时燃烧,以与水反应,所以,应密封,放置阴凉处保存,并远离火源。
3.25mol/L×0.2L=0.65mol,即电解池阴极有0.75molH+得到了0.65mol电子,所以燃料电池的负极消耗C4H10 的体积为(0.65mol÷26)×22.4 mol/L=0.56L=560ml
[答案](1)2C4H10+13O2=8CO2+10H2O (2)O2+2CO2 +4e-→2CO32-
(3)CO2 负极反应产物
(4)①2Cl-+2H2O Cl2↑+H2↑+2OH- ②5Cl2+I2+6H2O=10HCl+2HIO3 ③560
Cl2↑+H2↑+2OH- ②5Cl2+I2+6H2O=10HCl+2HIO3 ③560
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com