
题目列表(包括答案和解析)
19.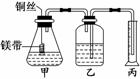 某研究性学习小组为证明在同温同压下,相同浓度、
某研究性学习小组为证明在同温同压下,相同浓度、
相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气
的体积相同而反应速率不同,同时测定实验室条件下的气体摩
尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤
如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液.
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端.
④检查装置的气密性,在广口瓶中装满水,按图连接好装置.
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 .
⑥反应结束后,读取量筒内水的体积为 y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管.
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 .
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 .
(4)简述速率不等的原因 ,铜丝不与酸接触的原因 .
18. (2009·厦门模拟)“探险队员”--盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过.
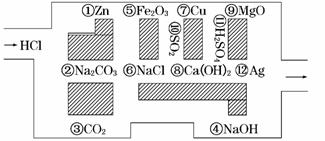
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)________________.
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________,写出该反应的离子方程式________________________________________________.
(3)在不能与盐酸反应的物质中,属于电解质的是__________(填写物质序号),属于非电解质的是________.
(4)如果将盐酸换成氯气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
______________________________________________________________________.
17、下图是几种盐的溶解度曲线,下列说法中正确的是
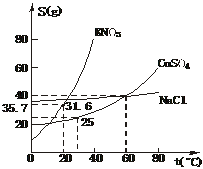
A.40℃时,将35 g食盐溶于100 g水中,降温至0℃时,可析出NaCl晶体
B.20℃时KNO3饱和溶液的溶质质量分数为31.6%
C.60℃时,200 g水中溶解80 g CuSO4达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g KNO3和35 g NaCl同时溶于100 g水中,蒸发时先析出的晶体是NaCl
16.(2010四川理综卷,12)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是 ( )
A.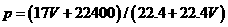 B.
B. 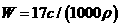
C. 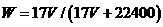 D.C=1000Vρ/(17V+22400)
D.C=1000Vρ/(17V+22400)
15.已知32gX和40gY恰好完全反应,生成mgQ和9gH,在相同条件下,16gX和30gY混合反应生成0.25molQ及若干摩尔H,则物质Q的摩尔质量应是( )
A.163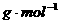 B.126
B.126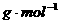 C.122
C.122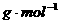 D.63
D.63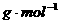
14.在标准状况下,称量一个充满氯气的容器质量为74.6克,若改充氮气,其质量为66克,则容器的容积为( )
A、11.2L B、5.6L C、4.48L D、2.24L
13.某学生配制了100 mL 1 mol/L的硫酸溶液.然后,对溶液浓度做精确测定,且测定过程中一切操
作都正确.结果测得溶液的物质的量浓度低于1 mol/L.那么,在配制过程中,下列操作可能导致溶液
浓度偏低的是 ( )
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到容积为100 mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
A.②③④ B.③④ C.①②③ D.①②③④
12.用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为 x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为 ( )
A.量筒 B.容量瓶 C.滴定管 D.以上均不对
11.(2010·滨州三模)阿伏加德罗常数的值约为6.02×1023mol-1,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P-P键数约是0.6×6.02×1023
②电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2×6.02×1023
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02×6.02×1023 (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
A.①②③④⑤ B.①③④⑤⑥ C.②③⑤⑥ D.③④⑤⑥
10.(2010四川理综卷)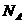 表示阿伏加德罗常数的值,下列说法正确的是 ( )
表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,22.4L二氯甲烷的分子数约为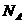 个
个
B.盛有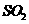 的密闭容器中含有
的密闭容器中含有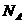 个氧原子,则
个氧原子,则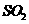 的物质的量为0.5mol
的物质的量为0.5mol
C.17.6g丙烷中所含的极性共价键为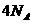 个
个
D.电解精炼铜时,若阴极得到电子数为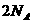 个,则阳极质量减少64g
个,则阳极质量减少64g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com