
题目列表(包括答案和解析)
6.
 下列实验能达到目的的是
下列实验能达到目的的是


|
|
|
|
5. 铅蓄电池
铅蓄电池 用途很广,电解液为30%的硫酸溶液,电池的总反应式可表示为:
用途很广,电解液为30%的硫酸溶液,电池的总反应式可表示为:
Pb(s)+ PbO2(s)+ H2SO4(aq) 2PbSO4(s) + 2H2O(l)
有关该电池的说法不正确的是
A.放电时负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
B.充电时阳极反应:PbSO4(s) + 2H2O(l) -2e- = PbO2(s) + 4 H+(aq)+SO42-(aq)
C.放电时,电解液的密度不断增大
D.充电时,电解液的pH不断减小
4.下列有关化工生产的叙述中正确的是
A.将煤液化、气化,有利于提高燃料的燃烧效率
B.侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱
C.电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
D.工业生产硫酸中,建立高烟囱可以降低地面SO2的浓度,减少空气污染
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1 mol Cl2发生反应时,转移的电子数一定是2 NA
B.标准状况下,2.24 L己烷中含有的非极性键数为0.5 NA
C.1 L 1 mol·L一1的 FeCl3溶液中含有铁离子的数目为 NA
D.常温常压下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA
2. 下列有关化学用语或
下列有关化学用语或 名称表达正确的是
名称表达正确的是
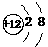 A.Mg的原子结构示意图:
B.乙酸分子的比例模型:
A.Mg的原子结构示意图:
B.乙酸分子的比例模型:
|
|
 C.H2O2的电子式:H+ [ O
O ]2- H+ D.
的名称:2-乙基丙烷
C.H2O2的电子式:H+ [ O
O ]2- H+ D.
的名称:2-乙基丙烷
1.化学与生活、社会密切相关。下列说法正确的是
A.臭氧能对水体消毒,是因为其能杀死水中的病菌
B.执行“限塑令”主要是为了节约资源
C.含磷洗涤剂不会导致水体污染,是因为其易被细菌分解
D.新装修的住房中放置任何花卉都能降低居室中甲醛含量
12、用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
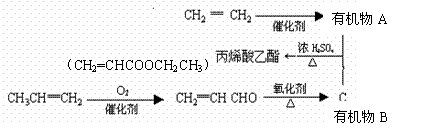
(1)由CH2=CH2制得有机物A的化学反应类型是 加成 ;
(2)丙烯醛[ CH2═CH-CHO ]中含有的官能团 醛基 和 碳碳双键 (填名称);
(3)A与B合成丙烯酸乙酯的化学反应方程式是:_______________________________;
该反应的类型是 酯化 (取代) 反应
(4)由石油裂解产物乙烯合成聚乙烯塑料的化学方程式是: 。
[例1] 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
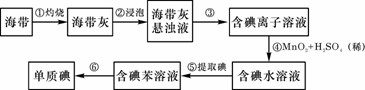
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
解析:本题设置了一个研究性学习的情境,并通过实验操作流程图的呈现,考查学生常见仪器的使用,萃取、分液、过滤、蒸馏等分离操作和简单物质的鉴别等知识的掌握情况。解答此类试题,要求学生了解常见化学仪器的功能及使用方法,掌握中学阶段化学实验的基本原理、实验步骤以及简单的实验设计,结合具体问题推出正确答案。本题能力层次为D,属较难题,难度系数0.50。
答案:(1)BDE (2)过滤 蒸馏 (3)2I-+ MnO2 + 4H+=== Mn2+ + I2 + 2H2O
(4)苯与水互不相溶;碘在苯中的溶解度比在水中大
(5)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)。
[例2]由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答:

(1)写出下列物质的化学式:乙 、丁 、戊 。
(2)写出甲物质在工业上的一种主要用途: 。
(3)写出A在元素周期表中的位置:第 周期,第 族。
(4)写出甲→乙+丙反应的离子方程式: ;
A→乙+C反应的化学方程式: 。
解析:本题通过给出A元素的特征信息和几种单质及其化合物的相互转化关系方框图,考查学生对元素周期表、铝及其化合物性质与变化等知识的掌握情况。重点考查学生从方框图示中获取有效信息的能力和综合运用所学知识分析和解决问题的能力。解答此类试题,要求学生不仅要掌握相关元素及其化合物的性质和用途,而且,还要求学生善于从试题中捕捉有关信息,进行综合分析、判断,得出正确结论。本题能力层次为C,属较难题,难点系数0.65。
答案:1)NaAlO2、 AlCl3、 Al (OH)3 2)冶炼金属铝的原料或做耐火材料(坩埚等)3)三 ⅢA 4)Al2O3+2OH-=2AlO2- +H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
[例3]“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
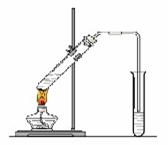
⑴写出制取乙酸乙酯的化学反应方程式:
。
⑵饱和碳酸钠溶液的主要作用是:
。
⑶装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑷若要把制得的乙酸乙酯分离出来,应采用的实验操作是:
。
⑸做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
11.下列说法中正确的是
A、将煤加强热使它分解的过程叫干馏
B、煤经过干馏, 可生产出焦炭、煤焦油、粗氨水、焦炉气等
C、石油经过减压分馏, 可以得到更多的汽油
D、石油通过裂化, 可以获得汽油、煤油、润滑油、凡士林和石蜡等
10.下列说法错误的是
A、石油中含有C5一C11的烷烃,可以通过石油的分馏得到汽油
B、含C18的烷烃的重油经过催化裂化可以得到汽油
C、煤是由有机物和少量无机物组成的复杂的混合物
D、煤中含有苯和甲苯,可以先用干馏后用分馏的方法把它们分离出来
9.冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是
A、(Ⅰ)用① B、(Ⅱ)用② C、(Ⅲ)用③ D、(Ⅳ)用④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com