
题目列表(包括答案和解析)
18. 某一反应物的浓度是2摩尔/升,经过两分钟的反应,它的浓度变成了1.6摩尔/升,求该反应的反应速率。
1、化学反应速率
用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
计算公式为=△C / △t 时间:(如每秒、每分、每小时)
反应速率的单位:mol/(L•s ) mol/(L•min) mol/(L•h)
(1) 现表示的化学反应速率是平均速率,同一反应用不同物质表示的化学反应速率数值可能不同,必须注明物质。
(2)起始浓度不一定按比例,但是转化浓度一定按比例。
(3) 同一反应各物质的反应速率之比等于化学计量数之比。
例:
2A(g)+3B (g) C(g)+4D(g) ν(A):ν(B):ν(C):ν(D) = 2 :3 :1 :4
C(g)+4D(g) ν(A):ν(B):ν(C):ν(D) = 2 :3 :1 :4
[练习]
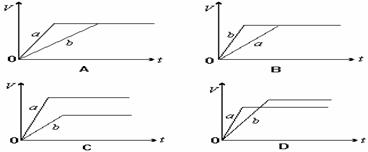
17. 等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是:( D )
第三节 化学反应的速率和限度
16. 把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
15. 往盛有纯Zn和稀H2SO4的容器中,滴入少量的CuSO4溶液,反应的速率会 加快 。
这是因为滴入CuSO4溶液后,Zn将Cu2+置换成Cu,Cu附在Zn的表面。此时Zn、Cu和稀H2SO4形成了无数个微小的 原电池 。(H+在Cu表面得电子比在Zn表面更易得到电子。因为Zn周围有Zn2+,H+受Zn2+的排斥。)从而使反应速率大大加快。
14. 下列说法正确的是( )
A.原电池是把电能转化为化学能的装置 B.原电池中电子流出的是正极发生氧化反应
C.原电池两极发生的均为氧化还原反应 D.形成原电池后,阳离子向正极移动
4、电解应用举例
①、电解熔融氯化钠
(1)电极反应: 阴极:2Na++2e- =2Na 阳极:2Cl--2e- = Cl2↑
(2)电解总的化学方程式 2NaCl(熔融)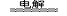 2Na+
Cl2↑
2Na+
Cl2↑
②、电解熔融氯化镁
(1)电极反应: 阴极:Mg2++2e- = Mg 阳极:2Cl--2e- = Cl2↑
(2)电解总的化学方程式 MgCl2(熔融)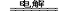 Mg+
Cl2↑
Mg+
Cl2↑
③、电解熔融氧化铝
(1)电极反应: 阴极:4Al3++12e- =4Al 阳极:6O2-+12e- =3O2↑
(2)电解总的化学方程式 2Al2O3(熔融)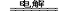 4Al+3O2↑
4Al+3O2↑
[练习]
3、电极名称:阴极:与电源负极相连的电极称为阴极,发生还原反应。
阳极:与电源正极相连的电极称为阳极,发生氧化反应。
2、电解原理:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
1、电解池:将电能转化为化学能的装置叫电解池。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com