
题目列表(包括答案和解析)
7.5 g-0.1 mol×65 g·mol-1=1.0 g。
Zn + CuSO4===ZnSO4 + Cu Δm(固)
65 g 1 mol 64 g 1.0 g
Cu + 2H2SO4(浓)CuSO4+SO2↑+2H2O
2 mol 1 mol
c(H2SO4)==17.5 mol·L-1
0.1 mol 0.1 mol 0.1 mol
Zn与CuSO4反应固体减轻:
21.向铜片中加某浓度的硫酸120 mL,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500 mL,再加入足量锌粉,使之充分反应收集到标准状况下气体2.24 L,过滤残留固体,干燥后称量,质量减轻了7.5 g,求原硫酸的物质的量浓度。
解析:Zn + H2SO4(稀)===ZnSO4+H2↑
20.(2009·全国卷Ⅰ)浓H2SO4和木炭在加热时发生反应的化学方程式是
2H2SO4(浓)+CCO2↑+2H2O+2SO2↑

请从上图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
|
|
|
|
|
|
解析:本题为气体的制取与性质检验。选择的装置连接顺序为C→B→A→A→A(或C→B→A→A→A→A),加入的试剂依次为木炭和浓H2SO4、无水CuSO4、品红溶液、酸性KMnO4溶液、澄清石灰水(也可在酸性KMnO4溶液后加品红溶液),作用分别是制取气体,检验H2O(g)、检验SO2、除去SO2、检验CO2。
答案:
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
C |
浓H2SO4和木炭 |
反应器(或发生气体) |
|
B |
无水CuSO4 |
检出H2O |
|
A |
品红溶液 |
检出SO2 |
|
A |
酸性KMnO4溶液 |
吸收余下的SO2 |
|
A |
澄清石灰水 |
检出CO2 |
19.某亚硫酸钠试剂,已部分被氧化。为确定其纯度,要进行如下实验:①称取样品W1 g;②将样品溶解;③向溶液中加入稍过量盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2 g,回答:
(1)BaCl2要用盐酸酸化的原因是____________________________。
(2)BaCl2溶液要稍过量的原因是____________________________。
(3)判断操作③完成的方法是____________________________。
(4)判断沉淀洗净的方法是____________________________。
(5)Na2SO3纯度的表达式:____________________________。
答案:(1)完全除去Na2SO3,避免生成BaSO3沉淀 (2)使SO完全沉淀 (3)在上层清液中继续加入盐酸酸化的BaCl2溶液,无沉淀产生 (4)在最后一次洗涤液中加入AgNO3溶液,无白色沉淀产生 (5)1-×100%
18.(2009·靖江模拟)“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物。
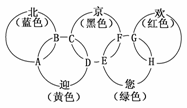
已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1 mol G可与1 mol“您”恰好反应生成1 mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅炼可制得A,此反应是工业上制取酸M的基础反应。请回答下列问题:
(1)“京”是________,“欢”的同素异形体是________。
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:__________________________,该反应为氧化还原反应,还原产物为___________________。
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气得到一种化肥,写出该肥料的化学式:___________________________。
答案:(1)铁 白磷
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2 FeCl2
(3)(NH4)2SO4
17.某待测溶液中可能含有SO、SO、CO、Cl-、NO、HCO、S2-等离子,进行下列实验如图所示[所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量]。
待测液
(1)判断待测溶液中有无SO、SO,并说明理由_____________________________
________________________________________________________________________。
(2)沉淀B为______________________________________________________________。
(3)沉淀A可能是__________________________________________________________。
(4)写出生成沉淀B的离子方程式:___________________________________________。
答案:(1)SO、SO至少有一种;因为沉淀D不溶于稀HNO3,一定为BaSO4,它可能由BaSO3氧化而来,也可能由Ba2+与SO生成
(2)S
(3)BaSO4、BaCO3或BaSO3、BaCO3或BaSO4、BaSO3和BaCO3
(4)S2-+Cl2===S↓+2Cl-
16.(2009·北京)下列叙述正确的是 ( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不改变
解析:A项:弱酸一般不能制强酸,错误;B项:加入Cu(NO3)2因反应3Cu+8H++2NO===3Cu2++2NO↑+4H2O使铜粉溶解,错误;D项:因形成原电池使反应速率加快,错误。
答案:C
15.(2009·山东)下列推断合理的是 ( )
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
解析:B项:金刚石可在O2中燃烧;C项:Cu与浓H2SO4在常温下不反应;D项:SO2通入溴水,SO2被氧化成SO,加热后不会恢复原色。
答案:A
14.(2009·合肥模拟)如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是 ( )
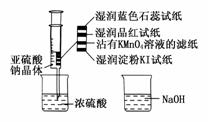
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.湿润淀粉KI试纸变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com