
题目列表(包括答案和解析)
7.X、Y、Z、W四种元素在元素周期表中的相对位置如图所示,Y、Z的质子数之和为21,下列说法正确的是( )
|
|
X |
|
Y |
|
Z |
|
W |
|
A.常压下,四种元素的单质中,W单质的熔点最高
B.Z的阳离子与Y的阴离子电子层结构相同
C.X的气态氢化物比Y的气态氢化物稳定
D.W元素的金属性比Z元素的金属性强
解析:选B。Y、Z的质子数之和为21,再根据题图,可知Y、Z都应是短周期元素,则它们的原子序数差为5,由此推出Y是O,Z是Al,则X、W分别为C、P。四种单质中碳(X)单质的熔点最高,A错;C、O同周期,O的非金属性比C强,所以H2O比CH4稳定,C错;Al是金属,而磷是非金属,所以D错。
6.要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验( )
A.Cu、FeCl2溶液、MgCl2溶液
B.Fe、Cu、MgCl2溶液
C.Mg、CuO、FeSO4溶液
D.Fe、CuSO4溶液、MgCl2溶液
解析:选D。判断金属活动性顺序的依据之一是金属间的置换反应,利用D所给的试剂,Fe能够从CuSO4溶液中置换出铜,但不能从MgCl2溶液中置换出Mg。
5.下列各项关系正确的是( )
A.熔点:K>Na>Li
B.离子半径:Mg2+>F->O2-
C.热稳定性:NaHCO3>Na2CO3>CaCO3
D.酸性:HClO4>HBrO4>HIO4
解析:选D。碱金属元素自上而下,熔点依次降低,A错;Mg2+、F-、O2-具有相同的电子层结构,随原子序数的逐渐增大,半径逐渐减小,即Mg2+<F-<O2-,B错;碳酸氢钠没有碳酸钠稳定,C错。
4.没有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法中正确的是( )
A.34S原子核内的中子数为16
B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2
D.2H+的酸性比1H+的酸性更强
解析:选B。34S原子核内的中子数为18,13C和15N原子核内的质子数相差1,同位素的化学性质几乎完全相同,所以2H+和1H+的酸性相同,A、C、D错误;由于1H216O的相对分子质量比1H218O小,所以分子间作用力小,因而更易蒸发。
3.“神舟七号”所用动力燃料之一为氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,下列叙述中正确的是( )
A.三种物质质子数之比为1∶2∶3
B.三种物质中子数之比为1∶1∶1
C.三种物质的摩尔质量之比为8∶9∶10
D.三种物质的化学性质不相同
解析:选C。H、D、T是氢的三种同位素,故它们的质子数相等,所以三种物质的化学性质相同,质子数之比为1∶1∶1,A、D错;三种物质中子数之比为4∶5∶6,B错。
2.(2008年高考上海卷)化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
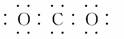
A.CO2的电子式··
B.Cl-的结构示意图
C.乙烯的结构简式C2H4
D.质量数为37的氯原子Cl

应为CH2===CH2,故C项错误;质量数为37的氯原子应表示为Cl,故D项错误。
1.下列说法中不正确的是( )
①质子数相同的粒子一定属于同种元素;②同位素的化学性质几乎完全相同;③某种元素的原子其相对原子质量取整数,就是其质量数;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数。
A.①②④⑤ B.③④⑤
C.②③⑤ D.①③⑤
解析:选D。质子数相同的原子一定是同种元素;同位素的化学性质几乎完全相同;电子数相同的粒子不一定是同种元素,如10个电子的微粒可以是H2O也可以是NH3;由于元素有多种同位素,所以一种元素的质量数不止一种。
21.(10分)已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净的CuSO4溶液的方法,根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验过程如图所示:
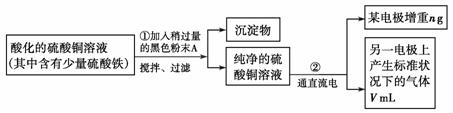
(1)步骤①所加的A的化学式为 ;加入A的作用是
___________________________________________________。
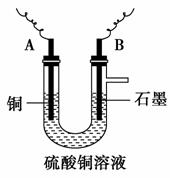
(2)步骤②中所用的部分仪器如图所示,则A、B分别连接直流电源的 极和 极(填“正”或“负”)。
(3)电解开始一段时间后,在U形管中观察到的现象有____________________________;
电解的离子方程式为_____________________________。
(4)下列实验操作中必要的是(填字母) 。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为________(用带有n、V的计算式表示)。
解析:(1)为防止引入新的杂质,黑色粉末应为CuO;CuO起到消耗溶液中的H+,从而促进Fe3+的水解,形成Fe(OH)3沉淀,除去Fe3+的作用。
(2)由②的实验结果可推知,石墨作阳极,铜作阴极,所以A连接电源的负极,B连接电源的正极。
(3)因Cu2+得电子逐渐生成单质铜,铜棒逐渐变粗,溶液中的Cu2 +的浓度逐渐降低,蓝色逐渐变浅,而石墨电极有无色气体产生。
(4)实验中铜的析出量是由铜棒的变化量确定的,故应准确称量铜棒电解前后的质量。符合操作要求的有A、B、D、E。
(5)将所得数据代入电解方程式进行计算,即可求得铜的相对原子质量。
答案:(1)CuO 消耗H+,调节溶液的pH至4-5,使Fe3+沉淀完全 (2)负 正 (3)溶液的蓝色变浅,A极变粗,B极上有气泡产生 2Cu2++2H2O2Cu+4H++O2↑ (4)ABDE (5)11200n/V
20.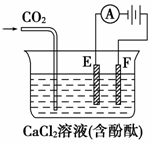 (8分)右图为持续电解饱和CaCl2水溶液的装置(以铂为电极,Ⓐ为电流表)。电解一段时间t1后(溶液中氯离子完全电解),将CO2连续通入电解液中,请回答有关问题。
(8分)右图为持续电解饱和CaCl2水溶液的装置(以铂为电极,Ⓐ为电流表)。电解一段时间t1后(溶液中氯离子完全电解),将CO2连续通入电解液中,请回答有关问题。
(1)电解时F极发生 反应,电极反应式为: ;E极的电极反应式为: ;电解的总化学方程式为: 。
(2)电解池中产生的现象:
①______________________________________________;
②_____________________________________________________;
③___________________________________________________。
解析:饱和CaCl2溶液电解后呈碱性,所以通入二氧化碳生成碳酸钙沉淀,所以溶液中的钙离子、氢氧根离子逐渐减少至没有,然后碳酸钙与二氧化碳反应生成碳酸氢钙,该物质电离,溶液中又存在钙离子和碳酸氢根离子。
答案:(1)氧化 2Cl--2e-===Cl2↑(或2Cl-===Cl2↑+2e-) 2H++2e-===H2↑ CaCl2+2H2OCa(OH)2+Cl2↑+H2↑
(2)①通电时,F极放出黄绿色气体,E极放出无色气体
②通电后,E极附近溶液变为红色 ③通CO2时先产生白色沉淀,后又完全溶解
19.(12分)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)烧杯间填满碎木屑的作用是_________。
(2)环形玻璃搅拌棒能否用环形铜质搅拌棒代替? (填“能”或“不能”),其原因是___________________________________。
(3)为什么要用0.55 mol·L-1的氢氧化钠溶液?
____________________________________________________;
实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所测得的中和热
(填“相等”或“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为: ________________________________________________________。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是________(填字母代号)。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天,室温较高
D.将50 mL 0.55 mol·L-1的氢氧化钠溶液换成了50 mL 0.55 mol·L-1的氨水
E.在量取盐酸时仰视读数
F.大烧杯的盖板中间小孔太大
解析:(1)碎木屑的作用是减少实验过程中的热量损失,使实验测定的中和热误差更小。
(3)选用0.55 mol·L-1的NaOH溶液,是为了保证盐酸全部被NaOH中和。原溶液中NaOH和HCl生成的水的物质的量为:0.050 L×0.50 mol·L-1=0.025 mol,改用60 mL 0.50 mol·L-1的盐酸并中和完全后生成水的物质的量为0.050 L×0.55 mol·L-1=0.0275 mol。后者生成的水多了,因而放出的热量也增多了,但所测定的中和热是相同的,因为中和热是指生成1 mol液态水时的反应热,与生成水的多少无关。
(5)A无影响。B倒NaOH溶液时动作迟缓,将导致散失部分热量,结果偏低。C室温对测量结果无影响。D用氨水代替NaOH,NH3·H2O自身电离会吸收部分热量,使测得的中和热数据偏小。E量取盐酸时仰视,导致量取盐酸的体积比读数大,使测得的中和热数据偏大。F盖板中间小孔太大,散失部分热量。
答案:(1)保温隔热,减少实验中的热量损失
(2)不能 铜质搅拌棒导热,会损失热量
(3)保证盐酸完全反应 相等
(4)H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
(5)BDF
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com