
题目列表(包括答案和解析)
19.(8分)将9.2 g N2O4晶体放入容积为2 L的密闭容器中,升温到25 ℃时,N2O4全部气化,由于N2O4发生如下分解反应:N2O4(g)  2NO2(g)(正反应吸热)。平衡后,在25 ℃时测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍。
2NO2(g)(正反应吸热)。平衡后,在25 ℃时测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍。
试回答:
(1)平衡时容器内NO2和N2O4的物质的量之比为_____________。
(2)平衡时该反应的平衡常数K为________。
解析:由题意知:n(N2O4)==0.1 mol,由于=且p后=1.2p前,故n后=1.2n前=1.2×0.1 mol=0.12 mol。
N2O4(g)  2NO2(g) Δn
2NO2(g) Δn
1 2 1
n(N2O4) n(NO2) 0.02 mol
反应的N2O4为:n(N2O4)=0.02 mol
生成的NO2为:n(NO2)=0.04 mol
剩余的N2O4为n(N2O4)=0.08 mol
故(1)平衡时:n(NO2)∶n(N2O4)=0.04 mol∶0.08 mol=1∶2。
(2)c(NO2)===0.02 mol/L,同样可求得:c(N2O4)=0.04 mol/L。
根据化学平衡常数K的定义公式,很容易得出:K===0.01。
答案:(1)1∶2 (2)0.01
18.(8分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol
A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
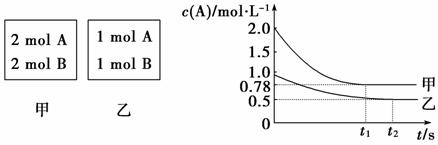
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
解析:(1)乙容器反应达到平衡时c(A)=0.5 mol·L-1,转化率为50%。
(2)甲容器反应达到平衡时,c(A)=0.78 mol·L-1,转化率为61%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,x=1。
(3)反应达到平衡时,乙容器中c(A)=c(B)=c(C)=0.5 mol·L-1,T ℃时,该反应的平衡常数为2。
(4)A项,向平衡后的乙容器中充入惰性气体氦气,气体的浓度不变,平衡不发生移动,c(A)不变;B项,将乙容器单独升温,平衡逆向移动,A的体积分数增大,更大于甲容器中A的体积分数;C项,若向甲容器中再充入2 mol A、2 mol B,达到平衡时A的转化率比不加前增大,所以平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1。
答案:(1)50% (2)1 (3)2 (4)C
17.(12分)(2009年高考安徽卷)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
|
实验编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
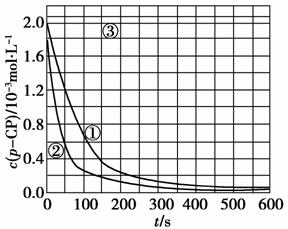
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50-150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:___________________________________________________。
(4)实验③得出的结论是:pH等于10时,__________________________________________________________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:___________________________________________________________。
解析:本题为实验探究题,充分体现新课标精神,有一定难度。
(1)依题意可知②的实验温度为313 K,实验对比是建立在其它条件相同前提下,故pH应与①的相同。若改变pH,其它条件不变可探究溶液pH对反应速率的影响。
(2)实验①曲线中,50-150 s时:
Δc(p-CP)=1.2×10-3 mol·L-1-0.4×10-3 mol·L-1=0.8×10-3 mol·L-1,所以v(p-CP)==8.0×10-6 mol·L-1·s-1。
(3)在降解反应中,H2O2新产生的自由基起氧化作用,温度过高,H2O2因热稳定性差而分解,导致降解反应速率下降。
(4)由曲线③可知,pH=10时,c(p-CP)基本不变,反应趋于停止。
(5)由(4)得到启示:在pH=10溶液中,反应速率趋于零,可将所取样加入NaOH溶液中(使pH=10);化学反应速率随温度降低而降低,故亦可用迅速大幅降温法。
答案:(1)
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
|
|
|
|
|
|
② |
|
313 |
3 |
6.0 |
0.30 |
|
③ |
探究溶液的pH对降解反应速率的影响 |
|
|
|
|
(2)8.0×10-6
(3)过氧化氢在温度过高时迅速分解
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
16. 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)
600 ℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g) 2SO3(g);ΔH>0。反应过程中SO2、O2、SO3物质的量的变化如右图所示,下列说法中不正确的是( )
2SO3(g);ΔH>0。反应过程中SO2、O2、SO3物质的量的变化如右图所示,下列说法中不正确的是( )
A.反应从0 min 开始,到第一次平衡时,二氧化硫的转化率为40%
B.反应进行到10 min至15 min时,曲线发生变化可能是因为升高了温度
C.反应进行至20 min时,曲线发生变化是因为通入了氧气
D.在15 min-20min、25 min-30 min内时反应处于平衡状态
解析:选A。反应从0 min开始,到第一次平衡时,反应掉的二氧化硫为0.04 mol,所以其转化率为20%。
15.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g) 2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时HI的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时HI的体积分数也为φ的是( )
2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时HI的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时HI的体积分数也为φ的是( )
A.2 mol H2和1 mol I2(g)
B.3 mol HI(g)
C.2 mol H2和2 mol I2(g)
D.1 mol I2(g)和2 mol HI(g)
解析:选D。由于H2(g)+I2(g) 2HI(g)为一反应前后气体体积不变的反应,要保证所给情况下达平衡时HI体积分数不变,则将产物全转化为反应物之后,H2和I2(g)物质的量之比为1∶2即可,由此可知D正确。
2HI(g)为一反应前后气体体积不变的反应,要保证所给情况下达平衡时HI体积分数不变,则将产物全转化为反应物之后,H2和I2(g)物质的量之比为1∶2即可,由此可知D正确。
14.下列说法正确的是( )
A.放热反应的焓变小于零,熵变大于零
B.放热及熵增加的反应,一定能自发进行
C.放热反应的焓变大于零,熵变小于零
D.放热及熵减小的反应,一定能自发进行
解析:选B。放热反应的焓变一定小于零,但熵变不一定大于零,也不一定小于零,A、C错误;由ΔG=ΔH-TΔS可推知,当ΔH<0、ΔS>0时,反应一定能自发进行,B正确,D错误。
13.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
解析:选C。K1的表达式应为K1=;常温下,水分解产生O2,是H2和O2化合生成H2O(g)的逆反应,因此其平衡常数的数值应为K2的倒数,数值为5×10-82;由于三个反应都处在常温下,根据K值的大小可以得出三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2。
12.一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率相等
D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
解析:选C。参加反应的X、Y分别为(c1-0.1) mol/L、(c2-0.3) mol/L,所以有(c1-0.1) mol/L∶(c2-0.3) mol/L=1∶3,整理得:c2=3c1。平衡时,Y和Z的生成速率之比为3∶2,c1的取值范围为0<c1<0.14 mol/L。
0.5 mol-0.05 mol+0.02 mol/L×5 L=0.55 mol
2 s时的压强与开始时之比为
p2s∶p始=0.55∶0.5=1.1∶1。
60 s达到平衡时,设有x mol N2O4反应。则有
N2O4 2NO2
2NO2
起始(mol) 0.5 0
转化(mol) x 2x
平衡(mol) 0.5-x 2x
平衡时,气体总的物质的量为0.5 mol-x mol+2x mol=(0.5+x) mol,所以有=1.6,解得x=0.3。
平衡体系中含0.2 mol N2O4,N2O4的转化率为×100%=60%。
11.在100 ℃时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A.前2 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时体系内的压强为开始时的1.1倍
C.在平衡时体系内含N2O4 0.25 mol
D.平衡时,N2O4的转化率为40%
解析:选B。 N2O4  2NO2
2NO2
起始(mol) 0.5 0
转化(mol) 0.05 0.02×5
2 s时(mol) 0.5-0.05 0.02×5
v(N2O4)==0.005 mol·L-1·s-1
气体总的物质的量为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com