
题目列表(包括答案和解析)
8.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为 ( )
A.H2+2OH-===2H2O+2e-
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-===4OH-
答案:C
7.关于如图所示的原电池,下列说法正确的是 ( )
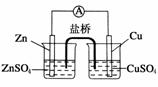
A.电子从锌电极通过电流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应为2H++2e-===H2↑
答案:A
6.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( )
A.两极材料都用石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极的反应式为Cl2+2e-===2Cl-
答案:B
5.分析如图所示的四个原电池装置,其中结论正确的是 ( )
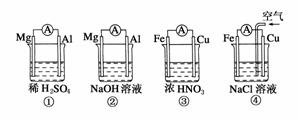
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-===H2↑
解析:Mg比Al活泼,在①中Mg做负极,但在NaOH溶液中,Mg不反应,而Al可以反应,故②中Al是负极。在浓HNO3中铁会钝化,故Cu为负极,Fe为正极。在④中由于不断向Cu极附近通入空气,而O2比溶液中的H+得e-能力强,故Fe失去的电子,在Cu极被O2得到。电极反应式为:O2+2H2O+4e-===4OH-。
答案:B
4.碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2+2H2O+2e-=2MnOOH+2OH-[来源:高&考%资(源#网]
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g
答案:C
3.(2009·潮阳模拟)利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是 ( )
A.铝罐将逐渐被腐蚀
B.碳棒上发生的反应为:O2+4e-===2O2-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒的质量会减轻
答案:A
2.(2009·巢湖模拟)将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是 ( )
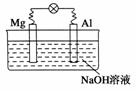
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
解析:对NaOH溶液而言Al比Mg活泼,故Al为负极,Mg为正极,负极电极反应式为:Al+4OH--3e-===AlO+2H2O,故A、B两项均不正确;内电路是阴、阳离子定向移动形成电流,故C项不正确;Al表面氧化膜不必另外处理,溶液中NaOH即可使其溶解,故D项正确。
答案:D
1.下列说法正确的是 ( )
A.构成原电池正极和负极的材料必须是金属
B.在原电池中,电子流出的一极是负极,该电极被还原
C.实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应
D.原电池可以把物质内部的能量全部转化为电能
答案:C
20.(2009·扬州调研)已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11.2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为__________________。
(2)取阳极区溶液作系列实验,下列结论中错误的是 ( )
A.滴加酚酞试剂,先变红后褪色
B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生
D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量(单位:kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少为多少m3?(折算成标准状况,假设该燃料电池的电量利用率为90%)
答案:(1)2Cl-+2H2O===2OH-+Cl2↑+H2↑
(2)A
(3)n(H2)==500 mol
n(总NaCl)=1000/0.9 mol
m(总NaCl)=1000/0.9 mol×58.5 g/mol=65000 g
m(NaCl溶液)=65000 g×136/36×10-3=245.6 kg
(4)由n(H2)=500 mol得:
n(CH4)=500 mol×2/8=125 mol
V(CH4)=125 mol×22.4 L/mol×10-3m3/L/0.9=3.1 m3
19.某研究小组对铁生锈进行研究。
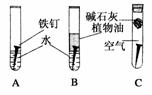
(1)甲同学设计了A、B、C一组实验[如图],探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈。①通过上述实验现象分析,可得出铁生锈的外部条件是__________________;②铁钉发生电化腐蚀的正极电极反应式为__________;③实验B所用的水要经过__________处理;植物油的作用是__________________;④实验C中碱石灰的作用是__________________。
(2)乙同学为了达到同样目的,设计了实验D[如图],发现一段时间后,试管中的液面升高,其原因是__________________,该实验__________(填“能”或“不能”)说明水对铁钉生锈产生影响。

(3)丙同学为了探究铁锈(Fe2O3·nH2O)的组成,将甲同学实验产生的铁锈刮下来,称取1.96 g这种铁锈,按如图所示装置进行实验。
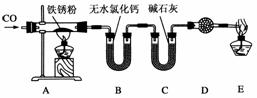
充分反应后,称得B装置的质量增加0.36 g,C装置的质量增加1.32 g,则根据实验数据,推断铁锈的化学式中n值为__________。
(4)为了保证实验安全,实验开始时应先点燃__________________(填“A”或“E”)处的酒精灯。
解析:(3)B装置中0.36 g水即n(H2O)=0.02 mol,C装置中1.32 g CO2即n(CO2)=0.03 mol,可推知Fe2O3中含n(O)=0.03 mol即n(Fe2O3)=0.01 mol。所以n(Fe2O3) ?n(H2O)=0.01?0.02=1?2,故答案可知。
答案:(1)①有水(或电解质溶液)和氧气(或空气) ②O2+4e-+2H2O===4OH- ③煮沸(或“除去氧气”),写“加热”不得分 隔绝空气(或“防止氧气与铁接触”) ④吸收水蒸气(或“干燥”、“保持试管内干燥环境”) (2)铁的腐蚀要吸收氧气(或“氧气参与反应”、“消耗了氧气”)使气体体积减少 不能 (3)2 (4)E
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com