
题目列表(包括答案和解析)
4.(2008年海南卷)1 mol X能与足量碳酸氢钠溶液反应放出448 L CO2(标准状况),则X的分子式是( )
A.C5H10O4
B.C4H8O4
C.C3H6O4
D.C2H2O4
3.如右图是某有机物分子的比例模型,有关该物质的推断不正确的是( )

A.分子中可能含有羟基
B.分子中可能含有羧基
C.分子中可能含有氨基
D.该物质的化学式可能为C3H6O3
2.下列各化合物的命名正确的是( )
A.CH2=CH-CH=CH2 1,3 - 二丁烯
B.

C.
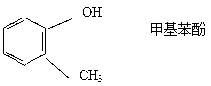
D.

1.从理论上分析,碳原子数为10或小于10的烷烃分子中,其一卤代物不存在同分异构体的烷烃分子共有的种类是( )
A.2种
B.3种
C.4种
D.5种
21. (11分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构,聚集状态为分子晶体的是(写分子式)________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于___________ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,
此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表
示),原子分布如图所示,该物质的化学式为 ___ 。

20.(10分)下面是A、B、C、D、E、F、G7种元素在周期表的位置。

据此回答下列问题:
(1)其单质可能形成原子晶体的元素(填元素符号):________;其单质一定能导电的主族元素________(填元素符号):
(2)A、C两元素形成的共价化合物中含有非极性键的是(写分子式):______________;D、C两元素形成的某离子晶体,其离子个数比为1:1,则该化合物电子式为:___________。
(3)A分别与B、C、E、F形成的四种化合物的固态都属于______(填写离子晶体、原子晶体或分子晶体),其晶体中有氢键的是_______________________。
19.(2010天津卷)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1
c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
18.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
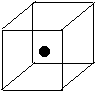 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
该反应的反应热△H = kJ/mol.
17.(10分)C60、金刚石和石墨的结构模型如下图所示(石墨仅表示出其中的一层结构):
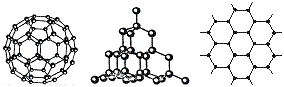
(1)C60、金刚石和石墨三者的关系是互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”),C60分子中含有双键的数目是________。
(3)硅晶体的结构跟金刚石相似,1mol硅晶体中含有硅硅单键的数目约是_____NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________。
16.(8分)从能源的角度看,“可燃冰”可视为被高度压缩的天然气资源,是天然气能量密度的2-5倍;“可燃冰”清洁无污染,燃烧后几乎不产生任何废弃物。可燃冰有三种结构,如图所示分别是结构I、结构Ⅱ和结构H。
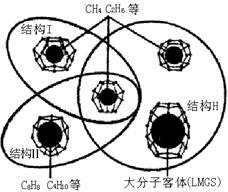
(1)试根据题意,写出其化学式
|
类型 |
结构 |
假定每个空隙囚禁分子数 |
化学式 |
|
结构I |
46个水分子通过氢键连接而形成,中间有8个空隙 |
2个空隙中各有一个水分子,另外6个空隙各有一个CH4分子 |
CH4·__H2O |
|
结构II |
136个水分子通过氢键连接而形成,中间有24个空隙 |
4个空隙中各有一个水分子,其余空隙各有一个C2H6分子 |
C2H6·___H2O |
(2)结构H型“可燃冰”单晶是由34个水分子通过氢键连接而形成的结构,其中4种不同的空隙中:假定3个空隙各囚禁一个CH4,2个空隙各囚禁一个C2H6和1个空隙囚禁C4H10,其余空隙中为空的。77.8g这种结构的可燃冰中的气体全部释放出来,完全燃烧其中的可燃气体,可产生的热量为kJ?(已知燃烧热:CH4:890kJ/mol;C2H6:1190kJ/mol;C4H10:2900kJ/mol)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com