
题目列表(包括答案和解析)
5.下列说法正确的是 ( )
A.冰熔化时,分子中H-O键发生断裂
B.原子晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
D.分子晶体中,分子间作用力越大,则分子晶体越稳定
4.下列有关化学研究的正确说法是 ( )
A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、HBr 、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
3.(2010全国卷1)下面关于SiO2晶体网状结构的叙述正确的是 ( )
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子
2.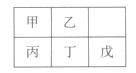 短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是( )
A.原子半径: 丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
1.下列判断错误的是 ( )
A.沸点: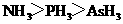 B.熔点:
B.熔点:
C.酸性: C.碱性:
C.碱性:
21.(11分)在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,在1L的密封容器中,在一定条件下发生如下反应。
N2(g)+3H2(g) 2NH3(g);ΔH<0
2NH3(g);ΔH<0
请根据图示回答下列问题:

(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)=_____∶_____。在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为________。
(2)在t1时,曲线发生变化的原因是________、_________。请计算氢气在t1起点时的坐标(______,______)以及在t2平衡时的坐标(____,____)。并在图中画出在t1-t2之间氢气的物质的量变化曲线。
(3)为达到图示中t2的平衡状态,在t1-t2之间需要采取的措施是______。
a.扩大容器的体积 b.升高温度
c.降低温度 d.缩小容器的体积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=____∶____,整个过程中N2和H2的总转化率之比a(N2)∶a(H2)=____∶____。
(5)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2):n(H2)=______。
20.(10分) 能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。
 (1)合成甲醇的反应为:CO(g)+2H2(g)
(1)合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);
CH3OH(g);
△H,图4-8表示某次合成实验过程中甲醇的体积分数
∮(CH3OH)与反应温度(T)的关系曲线,则△H 0,
工业上合成甲醇的适宜条件为 、 。
(2)在一定温度下,向一个容积不变的密闭容器中通入2.5molCO和7.5molH2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍,若保持同一反应温度将起始物质改为amolCO,bmolH2,cmolCH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b满足的关系为 ,且欲使开始时可逆反应向逆向方向进行,c的取值范围是 。
19.(10分) 在100℃和2×105Pa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(温度维持不变),下表列出不同压强下反应建立平衡时物质D的浓度。
dD(g)+eE(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(温度维持不变),下表列出不同压强下反应建立平衡时物质D的浓度。
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/mol·L-1 |
0.085 |
0.20 |
0.44 |
根据表中的数据,回答以下问题:
(1)压强从2×105Pa增加到5×105Pa时,平衡向 (正、逆)反应方向移动,判断的依据是 ;
(2)压强从5×105 Pa增加到×106Pa时,平衡向 (正、逆)反应方向移动,判断的依据是 。
18.(10分)以下是著名的碘时钟实验:
已知在酸性溶液中,碘酸钾和亚硫酸钠会发生如下一些反应
①IO3- +3HSO3- = 3SO42- + 3H+ + I- (慢)
②IO3- +5I- +6H+ = 3I2 + 3H2O(慢)
③I2 +HSO3- + H2O = 2I- +SO42- +3H+(快)
分别配制下面三种溶液。
溶液A:0.9g碘酸钾溶于少量温水中,再稀释到500mL。
溶液B:0.45g亚硫酸钠配成溶液,稀释到500mL。
溶液C:取5g可溶性淀粉,放在小烧杯中,加入25mL冷水,搅拌成悬浊液。另取200mL水加热至沸,趁沸腾时倒入淀粉悬浊液并迅速搅拌,使淀粉糊化、溶解。到溶液冷却后边搅拌边慢慢加入12.5mL浓硫酸,最后也稀释到500mL。
溶液 D:200mL水+50mLA液+50mL C液
溶液 E:225mL水+25mLA液+50mL C液
试回答下列问题、
(1)根据实验原理,化学反应速率由那步反应决定______________。(填①、②、③)
(2)当哪种离子耗尽时才能见到溶液变蓝色______.(选填:I-、HSO3-、H+、IO3-)
(3)在盛放D液和E液的两只烧杯里同时加入50mLB液。D、E两烧杯哪个溶液先变蓝色 ___________(填:D、E)
(4)为研究温度对反应速度的影响 准备三份E液(各300mL,配法同上)、用三支量筒分 别量取50mL B液,同时把三份B液分别加入下述不同温度的三份E液中。
a、第一份放在石棉网上加热到50℃左右,b、第二份维持在室温,c、第三份浸在冰水里冷却到近冰点。先变蓝色的是___________。(填:a、b、c)
17.(6分)平衡移动原理可解释许多化学现象和自然现象。下列两组反应能否实现?如能实现请简述实验方法:
(1)4H2 +
Fe3O4  3Fe + 4H2O,3Fe + 4H2O
3Fe + 4H2O,3Fe + 4H2O
 4H2 +
Fe3O4;
4H2 +
Fe3O4;
________________________________________________________________________
(2)SO2 + Br2 + 2H2O = 2HBr + H2SO4,2HBr + H2SO4=SO2 + Br2 + 2H2O;
_______________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com