
题目列表(包括答案和解析)
8.(2009·南京阶段检测)如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是 ( )
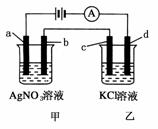
A.甲烧杯中溶液的pH降低
B.乙烧杯中c的电极反应式为2Cl--2e-===Cl2↑
C.当电解一段时间后,将甲、乙两溶液混合,一定会沉淀
D.当b极增重5.4 g时,d极产生的气体为2.24 L(标准状况)
答案:AB
7.(2009·常州模拟)如图为电解饱和食盐水的简易装置,下列有关说法正确的是
( )
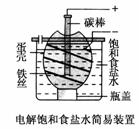
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
解析:蛋壳中碳棒连接的为电源的正极,为阳极,发生反应2Cl--2e-===Cl2,铁丝连接电源的负极,为阴极,发生反应2H++2e-===H2。明白各反应后可轻易判断出A、B、C均不正确。
[答案] D
6.(2009·平邑阶段测试)用质量均为100 g的铜片作电极,电解AgNO3溶液,电解一段时间后两极质量相差28 g,此时阳极质量为 ( )
A.121.6 g B.93.6 g C.89.6 g D.88.2 g
解析:设电解过程中电子转移n mol,阳极质量减少64×g,阴极质量增加108 ng.即108 n+64×=28,n=0.2 mol,阳极质量为:100 g-64×g=93.6 g。
答案:B
5.(2009·上海十四校联考)甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电流正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是 ( )
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的pH值逐渐升高,丙中溶液的pH值逐渐减小
解析:如图,可知甲为原电池,乙、丙为电解池,A项错误;C1、C3与电源正极相连为阳极,发生氧化反应(阳极区),C2、Fe与电源负极相连为阴极,在阴极区发生还原反应,甲中Zn为负极发生氧化反应,Cu为正极,其上发生还原反应,B错误;C1、C3上均放出Cl2,Cu片Fe片上放出H2,C正确。D项,甲中由于H放电,pH升高,乙中pH不变,丙中H+放电,pH升高,D项错误。
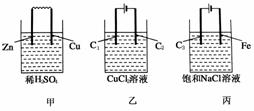
答案:C
4.(2009·吉林七校联考)如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是 ( )
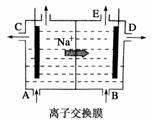
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO等离子,精制时先加NaCO3溶液
解析:由解饱和食盐水的反应方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑。由图中Na+向右侧移动可知右侧为电解池的负极,从E口逸出H2。A、B、C选项均正确。而D项,除去粗盐水中的SO需加入过量BaCl2,如果先加Na2CO3溶液,则过量的Ba2+无法除去。
答案:D
3.在25℃时,将两个Pt电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出a mol气体,同时有w g NaSO4·10H2O晶体析出,若温度不变,剩余溶液的溶质质量分数是 ( )
A.×100% B.×100%
C.% D.%
解析:用Pt电极电解Na2SO4溶液实质是电解水,由2H2O2H2↑+O2↑,结合题意阴极产生了a mol H2,故电解了a mol H2O,因为析出Na2SO4·10H2O之后溶液仍为饱和溶液,故Na2SO4溶液溶质的质量分数为:W(Na2SO4)%=w×/(w+18a)×100%。
答案:D
2.将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连,铂片与电源负极相连,以电流强度1 A通电10 min,然后反接电源,以电流强度2 A继续通电10 min。下列表示铜电极、铂电极、电解池中产生气体的质量和电解时间的关系图正确的是 ( )
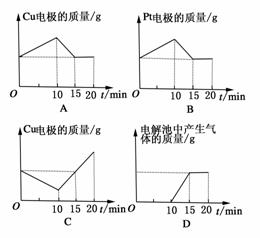
解析:开始10 min,阳极反应为:Cu-2e-===Cu2+,阴极反应为Cu2++2e-===Cu,所以铜片质量减少,铂片质量增加,铜片上所溶解的铜与铂片上析出的铜的质量相等。后10 min,电源反接,表面附有铜的铂片成为阳极,铜片成为阴极。又由于电流强度为开始时的2倍,附着在铂征上的铜在第5 min时即可完全溶解,后5 min,阳极的电极反应式为:4OH--4e-===2H2O+O2↑,此时阳极铂片质量不发生变化。作为阴极的铜片在第5 min时即恢复到开始时的质量,后5 min内质量继续增加。
答案:BC
1.下列关于电解槽的叙述中不正确的是 ( )
A.与电源正极相连的是电解槽的阴极
B.与电源负极相连的是电解槽的阴极
C.在电解槽的阳极发生氧化反应
D.电子从电源的负极沿导线流入电解槽的阴极
解析:本题重点考查电解池电极判断:阳极与电源的正极相连,阴极与电源的负极相连;电极反应:阳极发生氧化反应,阴极发生还原反应。电极流向:负极―→阴极;阳极―→正极。
答案:A
18.(2008·东营模拟)加热0.04 mol KMnO4固体,一段时间后,收集到a mol单质气体,此时KMnO4的分解率为x,在反应后的残留固体中加入过量的浓HCl并加热,充分反应后又收集到b mol单质气体,设Mn元素全部以Mn2+存在于反应后的溶液中。
(1)a+b=________(用x表示)。
(2)当x=________时(a+b)取最小值,且最小值为________。
(3)当a+b=0.09时,0.04 mol KMnO4加热后所生成残留固体的质量为________。
解析:n(O2)可由2KMnO4K2MnO4+MnO2+O2↑求得,a=0.02x mol。
由2KMnO4+16HCl===2MnCl2+2KCl+5Cl2↑+8H2O;
K2MnO4+8HCl===MnCl2+2KCl+2Cl2↑+4H2O;
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
可求得n(Cl2),
b=0.04(1-x) mol×5/2+0.04x mol+0.04x mol/2
=(0.1-0.04x) mol
(1)n(O2)+n(Cl2)=a+b=0.02x mol+0.1 mol-0.04x mol/2
=(0.1-0.02x) mol
(2)在上述推得的数学关系式a+b=0.1-0.02x中,x为分解率。由0<x<100%和数学极值原理可求得:0.08<a+b<0.1,即KMnO4完全分解(x=100%)时,a+b值最小为0.08。
(3)当a+b=0.09时,求得x=50%,由高锰酸钾分解反应式得:n(O2)=0.01 mol,则由质量守恒定律知:加热后剩余固体的质量等于原KMnO4,质量与放出O2质量的差,m(剩)=0.04 mol×158 g·mol-1-0.01 mol×32 g·mol-1=6g。
答案:(0.1-0.02x) (2)100% 0.08 (3)6 g
17.某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答下列问题。
该小组设计的简单实验装置如图所示:
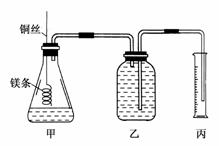
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
________________________________________________________________________
________________________________________________________________________。
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
解析:本题以化学计量和化学实验基础知识为背景,通过化学实验的形式考查气体摩尔体积的测定,探究实验中出现的问题,符合当前新课改的探究理念。
考虑到②10 mL量筒的精确度是0.1 mL,故应用10 mL量筒;③因HCl的物质的量为0.01 mol,由反应Mg+2HCl===MgCl2+H2↑知,HCl可与0.005 mol Mg完全反应,为保证HCl完全反应,故镁应不少于0.005 mol×24 g/mol=0.12 g。
(1)本装置可与初中化学制氢气的装置联系,用微热的方法检查装置的气密性。
(2)实验中产生的气体在标准状况下的体积为0.005 mol×22.4 L/mol=0.112 L=112 mL,考虑到室温时气体的体积稍大些,再考虑通常仪器规格应略大且越接近,误差越小,故选B。读数时注意量筒内的液面与集气瓶中液面相平,保证气压相等。
(3)Vm是气体的体积(排出水的体积)与气体的物质的量之比。若未除去表面的氧化膜,导致氧化膜耗酸,从而放出H2的体积变小,则Vm偏小。
答案:②10 mL量筒 ③0.12
(1)两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好。
(2)B 量筒内的液面与集气瓶内液面相平
(3)0.2V L·mol-1 偏小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com