
题目列表(包括答案和解析)
04.环境监测测定水中溶解氧的方法是:
①量取amL水样迅速加入足量的固定剂Mn4(aq)和碱性I(aq)(含H),立即塞好瓶子,并振荡摇匀,使之充分反应。
②测定:开塞后迅速加入适量硫酸(提供H+)使之生成I2,再用6ml/L的Na223(a q)滴定,消耗了VmL Na223(aq)(以淀粉为指示剂)。
q)滴定,消耗了VmL Na223(aq)(以淀粉为指示剂)。
有关的化学方程式为:2Mn2+ + 2 + 4H-= 2Mn(H)2 (该反应极快)
Mn(H)2 + 2I-+ 4 H+ = Mn2+ + I2 + 3H2
I2 + 2232-= 2I-+ 462-
试回答:
(1)水中溶解氧的量(以g·L-1为单位)为 。
(2)滴定时,以淀粉为指示剂,终点时溶液由 色变为 色。
(3)滴定管经水洗和蒸馏水洗后,直接加滴定剂Na223(aq),滴定时会导致测定结果 (填“偏高”、“偏低”或“无影响”)。
(4)若打开塞子加硫酸时动作缓慢,测定结果将 (填“偏高”、“偏低”或“无影响”)。
03.已知:①硫酸比氯酸稳定;②硫酸的酸性弱于高氯酸;③H2比Hl易被氧化;④Hl比H2更容易由单质合成;⑤盐酸的酸性比氢硫酸的酸性强。上述事实能够说明硫的非金属性比氯弱的是
A.①②③ B.③④⑤ .②③④ D.①③⑤
02.保险粉是连二亚硫酸钠(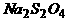 )的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaH混合,再通入
)的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaH混合,再通入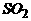 气体,所发生的化学反应是:HNa+2
气体,所发生的化学反应是:HNa+2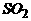 +NaH=
+NaH=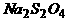 +
+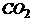 +
+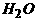 ,以下有关叙述中错误的是 ( )
,以下有关叙述中错误的是 ( )
A.在此反应中,HNa是还原剂,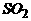 是氧化剂
是氧化剂
B.保险粉的还原性比HNa的还原性强
.NaH未被氧化也未被还原
D.甲醇虽未参加反应,但有助于保险粉的结晶、分离
01.工业上从含硒的废料中提取硒的方法之一是用H24 与NaN3处理废料获得亚硒酸和少量硒酸。加入盐酸共热,使硒酸转化为亚硒酸(H2e4+2Hl==== H2e3+ l2↑+ H2),再将2通入亚硒酸的溶液中,得到单质硒,据此分析,下列叙述正确的是
A.H2e4氧化性弱于l2 B.H2e3氧化性弱于H23
.H2e3还原性强于2 D.析出1 mle需H2e3、、2、H2各1 ml
00.下列粒子在化学反应中既能显示氧化性又能显示还原性的是 ( )
A.Fe3+ B.Br- .Al D.H22
499. R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合 ( )
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
498.G、、X、Y、Z均为含氯化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平)。①G→+Nal;②+H2→X+H2;③Y+NaH→G++H2;④Z+NaH→+X+H2。这五种化合物中的氯元素的化合价由低到高的顺序是( )
A.、G、Z、Y、X B.G、Y、、Z、X
.G、Y、Z、、X D.Z、X、G、Y、
497.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2=NaB2+4H2↑。下列说法中,正确的是(NaBH4中H元素为-1价)( )
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是还原剂,H2是氧化剂
.硼元素被氧化,氢元素被还原 D.被氧化的元素和被还原的元素质量比为1:1
496.根据下列反应,判断M、N、P、Q的还原性由强到弱的顺序是( )
①Nl2+P=N+Pl2; ②2Ml3+3N=2M+3Nl2;③3Ql2+2M=2Ml3+3Q
A.M>N>P>Q B.P>N>M>Q .Q>P>N>M D.N>M>P>Q
49.化合物A、B、都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B--X+,X是一种单质,由此可知X元素( )
A.一定是金属元素 B.一定是非金属元素 .可能是金属元素,也可能是非金属元素 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com