
题目列表(包括答案和解析)
9.(2008·宁夏高考)短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2 mol ECln与足量的AgNO3溶液完全反应后可以得到57.4 g的AgCl沉淀。下列判断错误的是 ( )
A.E是一种非金属元素
B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2
D.E位于元素周期表的ⅣA族
答案:D
8.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.水溶液能导电
B.由金属和非金属元素的原子构成
C.熔融状态能导电
D.可以溶于水
答案:C
7.下列说法正确的是 ( )
A.由分子组成的物质中一定存在共价键
B.由非金属元素组成的化合物一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.两个非金属元素原子间不可能形成离子键
答案:D
6.(2009·临沂模拟)短周期元素X、Y可以形成化合物XY2。下列有关叙述正确的是 ( )
A.若XY2是共价化合物,则X与Y的原子序数不可能相差1
B.若XY2是离子化合物,则X与Y的原子序数可能相差8
C.若X与Y的原子序数相差5,则离子化合物XY2不溶于水
D.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
答案:D
5.(2009·安徽江南十校模拟)北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是 ( )
A.K3C60中既有离子键,又有极性键
B.1 mol K3C60中含有的离子键数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
解析:A中K3C60中有离子键和非极性键;B中含有离子数目应为3×6.02×1023;D中物质的化学式不能简化。
答案:C
4.下列分子的电子数目与HF相同,且只有两个极性共价键的是 ( )
A.CO2 B.N2O
C.H2O D.CH4
答案:C
3.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键
( )
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.可能不形成化学键
答案:C
2.(2009·芜湖一中高三一模)关于氢键,下列说法正确的是 ( )
A.含氢元素的化合物中一定有氢键
B.氢键比分子间作用力强,所以它属于化学键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
解析:氢键是由化合物中的氢元素和非金属性较强、原子半径小的N、O、F三种原子形成的,所以A项错误;氢键属于分子间作用力,B项错误;氢键是分子间作用力,和化合物的稳定性无关,化合物的稳定性取决于分子或晶体内部的化学键强弱。
答案:C
1.(2009·唐山模拟)下列表达方式正确的是 ( )

答案:C
18.(2009·海淀)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体__________g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):__________。
|
名称 |
托盘天平(带砝码) |
小烧杯 |
坩埚钳 |
|
仪器 |
 |
 |
 |
|
序号 |
a |
b |
c |
|
名称 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
 |
 |
 |
|
序号 |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
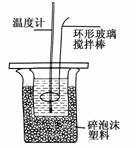
(1)写出该反应的热化学方程式(中和热为57.3kJ·mol):________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验 次数 |
起始温度T1/℃ |
终止温度T2/℃ |
温度差平均值(T2-T1)℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
答案:Ⅰ.(1)5.0 (2)a、b、e
Ⅱ.(1)H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(e);ΔH=-57.3kJ·mol-1
(2)①4.0 ②-53.5 kJ·mol-1 ③a、c、d
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com