
题目列表(包括答案和解析)
7.(2008·广东广州4月)已知:(1)Zn(s)+1/2O2(g)===ZnO(s);ΔH=-348.3 kJ·mol-1
(2)2Ag(s)+1/2O2(g)===Ag2O(s);ΔH=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)的ΔH等于 ( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
解析:根据盖斯定律,将反应(1)-(2)得到相应的反应,ΔH=-348.3 kJ·mol-1-(-31.0 kJ·mol-1)=-317.3 kJ·mol-1
答案:A
6.阿伏加德罗常数为NA,则关于C2H2(g)+O2(g)===2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1的下列说法中,正确的是 ( )
A.有10 NA个电子转移时,吸收1300 kJ的能量
B.有2 NA个CO2(气态)和NA个H2O(液态)生成时,放出1300 kJ的能量
C.有NA个水分子生成且为液体时,吸收1300 kJ的能量
D.有2NA个C2H2反应且为气态时,放出1300 kJ的能量
[答案] B
5.分析下图所示各物质能量变化关系,下列热化学方程式正确的是 ( )
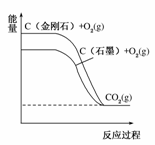
A.C(金刚石)+O2(g)===CO2(g);ΔH1=a kJ·mol-1(a<0)
B.C(石墨)+O2(g)===CO2(g);ΔH2=b kJ·mol-1(b>0)
C.C+O2===CO2(g);ΔH=c kJ·mol-1(c>0)
D.C(金刚石)===C(石墨);ΔH4=d kJ·mol-1(d>0)
[答案] A
4.100 g碳粉燃烧所得气体中,CO占,CO2占体积,且C(s)+CO2(g)===CO(g);ΔH=-110.35 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-282.57 kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是 ( )
A.392.92 kJ B.2489.44 kJ
C.784.92 kJ D.3274.3 kJ
[答案] C
3.(2009·山东省枣庄市高三第一学期期末检测)根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);
ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l);
ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g);高&考%资(源#网
ΔH=-Q3kJ·mol-1
对Q1、Q2、Q3三者大小关系的判断正确的是 ( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
[答案] A
2.下列变化为放热反应的是 ( )
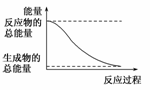
A.H2O(g)===H2O(l);ΔH=-44.0 kJ/mol
B.2HI(g)H2(g)+I2(g);ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
[答案] D
1.下列说法中正确的是 ( )
A.伴有能量变化的物质变化都是化学变化
B.放热反应在常温下一定很容易发生
C.吸热反应只有在点燃条件下才能发生
D.反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的
[答案] D
21.(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

①B中Sn极的电极反应式为__________________,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)__________。
②C中总反应离子方程式为__________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
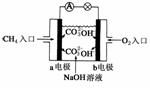
①电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
答案:(1)①2H++2e-===H2↑ 增大
②Zn+2H+===Zn2++H2↑ B>A>C
(2)①a
CH4+10OH--8e-===CO+7H2O
②减小
20.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
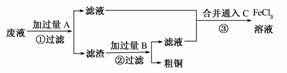
(1)写出一个能证明还原性Fe比Cu强的离子方程式__________________________,该反应在上图步骤________中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。

(2)分别写出上图步骤②、③相关反应的化学方程式:
步骤②___________________________________________________________________。
步骤③___________________________________________________________________。
(3)上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式________________________________________________________
________________________________________________________________________。
[答案] (1)Fe+Cu2+===Fe2++Cu①
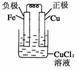
(2)Fe+2HCl===FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
(3)粗铜,Cu-2e-===Cu2+
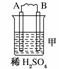
19.由A、B、C、D四种金属按下表中装置图进行实验。
|
装置 |
 |
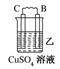 |
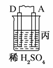 |
|
现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________。
(2)装置乙中正极的电极反应式是________。
(3)装置丙中溶液的pH________(填“变大”或“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是________。
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,活泼性A>B;乙中C增重,即析出Cu,则B为负极,活泼性B>C;丙中A上有气体即H2产生,则A为正极,活泼性D>A,随着H+的消耗,pH变大。
答案:(1)A-2e-=A2+ (2)Cu2++2e-=Cu (3)变大 (4)D>A>B>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com