
题目列表(包括答案和解析)
4.用下列装置不能达到有关实验目的的是 ( )
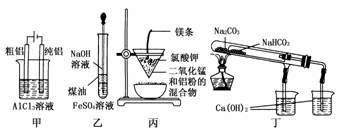
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
解析:甲中实际发生反应为:阳极:2Al-6e-===2Al3+;阴极:6H++6e-===3H2↑;电池总反应为2Al+6H2O2Al(OH)3↓+3H2↑。
答案:A
3.(2005·北京理综)将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( )
A.Mg、AlCl3、NaAlO2
B.KNO3、NaCl、CH3COONa
C.NaClO、Na2SO3、BaCl2
D.Ba(NO3)2、FeSO4、NH4HCO3
解析:B项中只发生反应CH3COO-+H+CH3COOH。
答案:B
2.(2007·海南)由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是 ( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
解析:由海水制备无水氯化镁的一条途径为:在苦卤或海水中加入熟石灰,使Mg(OH)2析出:
MgCl2+Ca(OH)2===CaCl2+Mg(OH)2↓,
再用盐酸溶解Mg(OH)2,然后将溶液浓缩,得到MgCl2·6H2O晶体,将MgCl2晶体在HCl中加热除去结晶水,即得无水氯化镁。
答案:D
1.长期食用铝含量过高的膨化食品,会干扰人的思维、意识与记忆功能,引起神经系统病变。摄入过量的铝,还能引发软骨症等。下列有关说法正确的是 ( )
A.因为铝对人体有害,故禁止使用铝锅等饮具
B.一种治疗胃酸过多的药物的主要成分是Al(OH)3,因此铝元素超标对人体无影响
C.膨化食品中的铝元素超标可能来自添加剂明矾
D.土壤的主要成分是Al2O3·2SiO2·2H2O,因此粮食中含有较多的铝元素,人过多食用含铝元素的食品显然也没有影响
解析:人体通过铝制炊具、药物摄入的铝元素很少,而土壤中的Al2O3不溶于水。
答案:C
22.(2009·山东)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
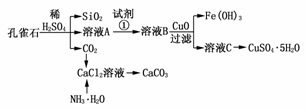
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________________________________________________________________。
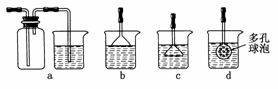
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到________。用KMnO4标准溶液滴定时应选用________(填“酸式”或“碱式”)滴定管。
解析:(1)试剂①的作用是将Fe2+氧化成Fe3+,同时不能引入新杂质,选c,检验Fe3+选d。(2)过滤前必须冷却结晶、过滤时必须用玻璃棒。(3)因CO2在水中的溶解度小,应先加入NH3·H2O,为防倒吸宜用b吸收NH3。(4)KMnO4溶液会腐蚀橡皮,滴定时宜选用酸式滴定管。
答案:(1)c d (2)冷却结晶 引流 (3)NH3·H2O b (4)平视凹液面(或平视刻度线) 凹液面的最低点与刻度线相切 酸式
21.有七种金属:钠、铝、铁、锡、铜、银、金,它们的标号分别为A、B、C、D、E、F、G。①常温下,只有A和水反应生成氢气;②D、E、G都能和稀硫酸反应生成氢气;③D、E、G中只有D与NaOH溶液反应;④B、F组成原电池时,F为正极;⑤将G、E组成的合金暴露在潮湿的空气中,经一段时间后,合金的表面有G的化合物出现;⑥用石墨电极电解含有相同物质的量浓度的B和C两种金属的硝酸盐溶液,B的单质先析出。回答下列问题:
(1)B的元素符号是________;G元素在元素周期表中的位置是________。
(2)D的最高价氧化物与A的最高价氧化物对应水化物发生反应的离子方程式为________________________。D的单质与G的最高价氧化物发生反应的化学方程式为____________________________,该反应在生产中有重要应用,被称为________反应。
(3)写出⑥中的电极反应式:阳极:_________________________________________,
阴极____________________________________________________________。
(4)将C的氯化物溶液蒸干灼烧得到的固体物质是________,原因是________________________________________________________________________
__________________________(用必要的文字和离子方程式表示)。
答案:(1)Ag 第四周期Ⅷ族
(2)Al2O3+2OH-===2AlO+H2O
2Al+Fe2O32Fe+Al2O3 铝热
(3)4OH--4e-===O2↑+2H2O
Ag++e-===Ag
(4)CuO CuCl2加热水解CuCl2+2H2OCu(OH)2+2HCl,随着HCl的挥发平衡右移,生成的Cu(OH)2经灼烧后分解生成了CuO
20.由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法。甲同学:在如图所示装置中,用铁屑、6 mol·L-1的硫酸、NaOH溶液制备。
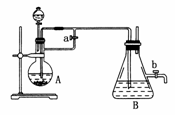
(1)实验开始时应先将活塞a________,活塞b________(填“打开”或“关闭”)。
(2)为了制得Fe(OH)2沉淀,在装置A和B中加入试剂后的实验步骤为________________________________________________________________________。
(3)这样生成的Fe(OH)2沉淀能较长时间不变色,其理由是________________________________________________________________________
________________________________________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为________________________________________________________________________
________________________________________________________________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
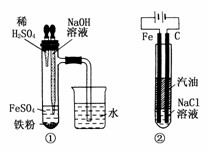

乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同。
(6)对乙同学的这一改变请你作出评价:____________________________________
________________________________________________________________________。
答案:(1)打开 关闭
(2)检验装置B出口处排出的H2的纯度,当排出的H2纯净时,关闭活塞a
(3)装置A中反应生成的H2充满了装置A和装置B,且外界空气不容易进入
(4)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(5)①②④
(6)反应中生成的H2S也能防止Fe(OH)2被氧化,白色沉淀能存在较长时间,但易产生空气污染物
19.(2009·莆田模拟)某同学在一只烧杯里装有a g纯铁粉,加入200 mL 6 mol/L硝酸恰好完全溶解铁粉(假设还原产物只有NO)。请完成对产物中铁元素价态的探究:
(1)提出合理假设:
假设1:产物只有+2价铁;
假设2: __________________________________________;
假设3: _________________________________________。
(2)设计实验:分别取反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。
推测实验现象与结论:①若现象为: _________________________________________,
则假设1正确;②若现象为: __________________________________________,
则假设2正确;③若现象为: ___________________________________________,
则假设3正确。
(3)a值范围为_________________________________________。
答案:(1)产物中只有+3价铁元素
产物中既含+2价又有+3价铁元素
(2)①甲试管溶液紫色褪去,乙试管没有明显变化
②甲试管溶液无明显变化,乙试管溶液变红色
③甲试管溶液颜色褪去,乙试管溶液变红色
(3)16.8≤a≤25.2
18.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。
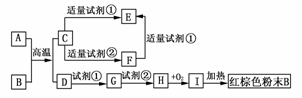
试推断:
(1)写出物质的化学式:A:________、C:________、I:________。
(2)写出下列反应的方程式:
C―→F的离子方程式___________________________。
H―→I的化学方程式_______________________。
解析:根据红棕色粉末可知B为Fe2O3,则I、H、G、D依次为Fe(OH)3、Fe(OH)2、Fe2+、Fe。A、D为金属单质,则A+BC+D为置换反应,C为金属化合物,试剂①为HCl,试剂②为NaOH,既能与酸反应,又能与碱反应的金属化合物C应为Al2O3,其余问题可迎刃而解。
答案:(1)Al Al2O3 Fe(OH)3
(2)Al2O3+2OH-===2AlO+H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
17.(2009·广东)下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
解析:A中除去的是CO2;B中除去的是BaCO3;D中Cu粉也能与稀HNO3反应。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com