
题目列表(包括答案和解析)
16.(2009·广东)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是 ( )
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
解析:A项:合金的熔点比任何一种成分的纯金属低;D项:生成Cu2(OH)3Cl发生了化学反应。
答案:B、C
15.(2009·深圳)用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①②③④是 ( )
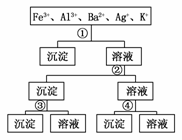
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4[来源:高&考%资(源#网]
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
解析:加入①时,只产生一种沉淀,故①一定是NaCl,沉淀为AgCl;在滤液中加入②后,生成两种沉淀,故②是NH3·H2O或NaOH,而生成的沉淀有一种在③中溶解,故②为NH3·H2O,③为NaOH,则④为H2SO4。
答案:D
14.(2009·安庆模拟)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cCaTiCl4+cCO 反应Ⅰ
TiCl4+2MgTi+2MgCl2 反应Ⅱ
(Ti的相对原子质量为48)
关于反应Ⅰ、Ⅱ的分析不正确的是 ( )
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于Ti,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④
C.③④ D.②⑤
解析:反应Ⅰ的化学方程式为:
TiO2+2Cl2+2CTiCl4+2CO
反应中C作还原剂被氧化,Cl2作氧化剂,TiCl4为还原产物,其还原性C>TiCl4。
反应Ⅱ的方程式为:
TiCl4+2MgTi+2MgCl2
该反应中,Mg作还原剂,还原产物为Ti,即还原性Mg>Ti,从反应Ⅰ、Ⅱ可知,每生成=0.4 mol Ti时,共转移电子的物质的量为:0.4 mol×(4+4)=3.2 mol。
答案:D
13.(2009·威海模拟)元素A的单质及A与B形成的化合物能按如图所示的关系发生转化。则下列说法正确的是 ( )
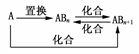
A.图中物质间的转化都不是氧化还原反应
B.当n=1时,A可能是N2
C.A一定是金属元素
D.当n=2时,A可能是Fe
答案:D
12.(思维拓展题)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是 ( )
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
答案:C
11.(2009·泰安模拟)将1.12 g铁粉加入25 mL 2 mol/L的氯化铁溶液中,充分反应后,其结果是 ( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显红色
C.Fe2+和Fe3+的物质的量之比为5?1
D.氧化产物与还原产物的物质的量之比为2?5
答案:B
10.在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液存在较多的阳离子是 ( )
A.Cu2+ B.Fe3+
C.Fe2+ D.H+
答案:C
9.某同学设计下列方法对A盐的水解液进行鉴定:
A
由此得出的结论中,不正确的是 ( )
A.D溶液中存在Fe(SCN)3
B.滤液中有Fe3+
C.B为AgBr
D.A一定为无氧酸盐FeBr2
答案:D
8.a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为 ( )
A.1:7 B.7:1
C.7:8 D.8:7
答案:B
7.(2009·怀远模拟)下列物质不能通过化合反应直接制得的是 ( )
A.FeCl2 B.NaHSO3
C.Cu(OH)2 D.Fe(OH)3
解析:FeCl2、NaHSO3、Fe(OH)3均可通过以下化合反应制得:
2FeCl3+Fe===3FeCl2
SO2+NaOH===NaHSO3
4Fe(OH)2+O2+2H2O===4Fe(OH)3
而Cu(OH)2不能通过化合反应直接制得。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com