
题目列表(包括答案和解析)
247.下列说法中正确的是()
A.化合反应中有氧化还原反应
B.分解反应中没有氧化还原反应
.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
翰林汇
246.以下变化中加入还原剂才能发生的是()
A.3 B.32-
B.32- 2
2
.Zn Zn2+
D.H24
Zn2+
D.H24 ____2
____2
翰林汇
24.下列反应属于氧化还原反应的是()
A.Na23+al2===a3↓+2Nal
B.2l2+2a(H)2===al2+a(l)2+2H2
.2NaH3 Na23+2↑+H2
Na23+2↑+H2
D.Fe+4===+Fe4
翰林汇
244.氧化还原反应的实质是(),判断是否是氧化还原反应的方法是()
A.元素是否有电子转移B.同一元素的化合价在反应前后是否有变化
.是否有氧元素参加D.是否是化合反应或分解反应
翰林汇
243.下列反应中氯元素被氧化的是()
A.l2+I2+6H2=10 Hl+2HI3
Hl+2HI3
B.Mn2+4Hl=Mnl2+2H2+l2↑
.2l2+2a(H)2=al2+a(l)2+2H2
D.2Hl=2Hl+2↑
翰林汇
242.已知2Fel3+2I=2Fel2+2l+I2,H2+I2=2HI+,下列叙述正确的是()
A.氧化性Fe3+>I2>
B.氧化性I2>>Fe3+
.还原性H2>I->Fe2+
D.还原性Fe2+>H2>I-
翰林汇
241.从反应①2Fe3++2I-===2Fe2++I2、②l2+2Fe2+===2Fe3++2l-上判断:
(1)氧化性由强到弱排列顺序正确的是()
(2)还原性由强到弱排列顺序正确的是()
A.l2>Fe3 +>I2
B.I->Fe2+>l-
+>I2
B.I->Fe2+>l-
.Fe3+>l2>I2 D.l->I->Fe2+
21.(6分)某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1 g NaCl放入500 mL烧杯中,加入150 mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100 mL,该溶液恰好与20 mL 0.100 mol·L-1 AgNO3溶液完全反应。试计算该容器的体积。
解析:首先根据AgNO3溶液计算出反应的NaCl的物质的量,然后根据NaCl的质量求出NaCl溶液的体积。
AgNO3+NaCl===AgCl↓+NaNO3
n(NaCl)=n(AgNO3)=0.100 mol·L-1×0.02 L=0.002 mol,m(NaCl)=0.002 mol ×58.5 g·mol -1=0.117 g,
V容器=100 mL×=30000 mL=30 L。
答案:30
2.(2)BCF
(3)0 小于 小于
(4)13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
20.(16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
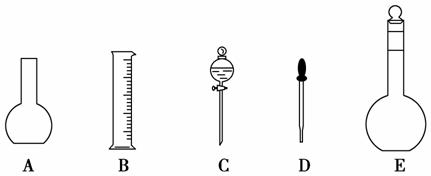
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________。
解析:(1)五种仪器分别为烧瓶、量筒、分液漏斗、胶头滴管、容量瓶,配制上述溶液肯定不需要烧瓶和分液漏斗,还需要烧杯、玻璃棒。
(2)容量瓶不能用于贮存、加热溶液,它只有一个刻度线,也不能测量容量瓶规格以下的任意体积的液体。
(3)因无450 mL的容量瓶配制NaOH溶液常用500 mL的容量瓶,m(NaOH)=c·V·M=0.1 mol/L×0.5 L×40 g/mol=2.0 g。定容仰视刻度线,造成加水较多,浓度偏低;洒落溶液会造成溶液浓度偏低。
(4)由稀释前后物质的量相等,V(浓)== L= L=13.6 mL,选用15 mL量筒最好,误差小。稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌。
答案:(1)AC 烧杯、玻璃棒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com