
题目列表(包括答案和解析)
15.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。下列说法不正确的是( )
 A.原子半径Y>Z>W
A.原子半径Y>Z>W
B.XW2熔点为 - 107℃,沸点为12.5℃,说明固态XW2为分子晶体
C.YW3水溶液蒸干并灼烧可得YW3固体
D.ZW2分子结构如右图,说明ZW2是极性分子
第Ⅱ卷(非选择题共55分)
14. 现有一种新型的无机非金属材料BN,它的一种同分异构体α-BN
现有一种新型的无机非金属材料BN,它的一种同分异构体α-BN
晶体为层状结构,平面结构示意图如右图所示,则关于该物质的结
构、性质和用途的叙述,正确的是 ( )
A.α-BN是一种坚硬耐磨材料,类似于金刚石
B.若层状结构中有n个硼原子,则有n个六元环
C.已知α-BN在水蒸气作用下能微弱水解,则水解产物为B2H6和HNO3
D.α-BN晶体中各原子均达到八电子稳定结构
13.氟化氢钾(KHF2)熔点225℃,晶体结构与NaCl类似。易溶于水,水溶液呈酸性,加热至310℃时有氟化氢逸出。用以制造无水氟化氢,熔融电解时可制得单质氟等。下列说法不正确的是 ( )
A.氟化氢钾晶体中每个K+紧邻的K+有12个
B.氟化氢钾晶体中的阳离子和阴离子的个数比为1:1
C.电解时可在阴极析出氟气
D.氟化氢钾溶液中,c(K+)>c(HF2-)
12.F2与Xe在 - 定条件下可生成XeF2、XeF4和XeF6三种氟化氙,
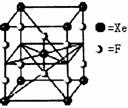 它们都有极强的氧化能力(其氧化能力依次递增),都极易水解,
它们都有极强的氧化能力(其氧化能力依次递增),都极易水解,
其中:6XeF4 + 12H2O = 2XeO3 + 4Xe↑ + 24HF + 3O2↑。下列
推测正确的是 ( )
A.XeF2分子中各原子均达到八电子结构
B.某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6
C.XeF4按已知方式水解,每生成4molXe,转移16mol电子
D.XeF2加入水中,在水分子作用下将重新生成Xe和F2
11. 阿伏加德罗常数约为6.02×1023mol-1,下列说法中一
阿伏加德罗常数约为6.02×1023mol-1,下列说法中一
定正确的是 ( )
A.60gSiO2晶体中,含有2×6.02×1023个Si - O键
B.18gD2O(重水)完全电解,转移2×6.02×1023个电子
C.720gC60晶体(如右图)中含有6.02×1023个晶胞结构单元
D.14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目
为3×6.02×1023个
10.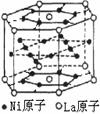 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为 ( )
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为 ( )
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
9.居室装修用石材的放射性常用 作为标准,居里夫人(MarieCurie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是 ( )
作为标准,居里夫人(MarieCurie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是 ( )
A.CaCl2的熔点比RaCl2高
B.RaCl2属于离子晶体,熔融状况下能导电。
C. 单质放出射线,实质上就是失去电子被氧化的过程。
单质放出射线,实质上就是失去电子被氧化的过程。
D.Ra(OH)2是一种强碱
8.(2010山东卷)下列说法正确的是 ( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
7.在某晶体中,与某一种微粒x距离最近且等距离的另一种微
粒y所围成的空间构型为正八面体型(如图)。该晶体可能
是 ( )
A.NaCl B.CsCl C.CO2 D.SiO2
6.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是 ( )
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
 C.Y的最高价氧化物对应的水化物能溶于稀氨水
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com