
题目列表(包括答案和解析)
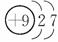
17. (12分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(12分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称 、 、 。
(2)B位于元素周期表中第 周期、第 族。
(3)C的原子结构示意图为 ,C的单质与H2反应的化学方程式为__________________________________________________。
(4)比较B、C的原子半径:B C(填“>”、“<”或“=”),写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式________________________________________________________。
解析:由A、B、C在周期表中的位置可知,A、C两种元素在第二周期,B在第三周期。
设A的原子序数为x,则C的原子序数为x+2,B的原子序数为:x+1+8。由题意可知:x+x+2=x+9,则x=7,则A、B、C三种元素分别为N、S、F。各小题根据要求,不难解答。
答案:(1)氮 硫 氟
(2)三 ⅥA
(3) F2+H2===2HF
(4)> NH3+HNO3===NH4NO3
16.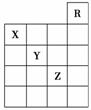 如图所示是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图所示是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐 ②Y、Z的气态氢化物的水溶液的酸性:Y<Z
③Z的单质在常温下是液体,可与铁粉反应 ④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素
A.①②③④ B.①②③④⑤
C.只有③ D.①④
解析:选A。从题中各元素在周期表中所处的位置,得出该图为元素周期表右上角的一部分,由此可以依次判断出各元素:R为He,X为N,Y为S,Z为Br。X的气态氢化物为NH3,而Y的最高价氧化物对应的水化物为H2SO4,它们可反应生成硫酸铵,①正确;Y、Z的气态氢化物分别为H2S、HBr,HBr的水溶液为强酸,H2S的水溶液为弱酸,故②正确;说法③符合客观事实,正确;Z的原子序数为35,而Y的原子序数为16,④正确;Z所在周期为第四周期,从19号元素开始,到36号元素结束,共18种元素,⑤错误。综上所述,正确的答案为A。
15.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子的少1。下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
解析:选AD。由X原子的最外层电子数是其电子层数的3倍知X为氧元素,又X、Y为同一主族的短周期元素,则Y为S,又由Y、Z同周期,Z原子的核外电子数比Y原子的少1,则Z为P元素;由元素周期律知三种元素的非金属性强弱为O>S>P,原子半径为P>S>O,气态氢化物的稳定性为H2O>H2S>PH3,硫的最高价氧化物对应水化物的化学式为H2SO4。
14.甲、乙两种非金属:①甲比乙容易与H2化合;②甲单质能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物的酸性强;④与某金属反应时,甲原子得到的电子数目比乙得到的多;⑤甲单质的熔点、沸点比乙的低。能说明甲比乙的非金属性强的是( )
A.只有④ B.只有⑤
C.①②③ D.①②③④⑤
解析:选C。比较元素非金属性强弱的依据有:与氢气化合的难易,最高价氧化物对应的水化物的酸性强弱,气态氢化物的稳定性,置换反应等,所以①②③可以说明甲比乙的非金属性强。
13.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。下列说法不正确的是( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的溶液能使酚酞试液变红
B.C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A-E的顺序依次增大
解析:选D。由题意可先推出B为C元素,C、D分别为N、O元素,结合A、E同主族,且五种原子核外电子层数之和为10,不难推出A为H元素,E为Na元素。A:2Na2O2+2H2O===4NaOH+O2↑;B:NH4NO3中既有离子键又有共价键;C:O与H、C、N、Na均能形成两种或两种以上的化合物;D:五种元素的原子半径由小到大的顺序为A<D<C<B<E,故D不正确。
12.下列各分子中,所有原子都满足最外层8个电子稳定结构的是( )
A.H2O B.BF3
C.CCl4 D.PCl5
解析:选C。A中H最外层只有2个电子;B中B最外层只有6个电子;C中各原子都满足8电子结构;D中P原子最外层有10个电子。
11.下列叙述正确的是( )
A.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1∶2
B.离子化合物中一定不含共价键
C.某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m-nR
D.元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等
解析:选D。A项:NaHSO4、Na2O2均为离子化合物,其晶体中阴、阳离子个数比分别为1∶1和1∶2。B项:离子化合物中可能含共价键如:NaOH、Na2O2。C项:最高价含氧酸为HnROm,则其氢化物应为H(8-2m+n)R。D项:L层电子为奇数的元素都在第二周期,都为主族元素,主族元素的族序数与最外层电子数相等。故选D。
10.核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是( )
A.元素X的原子核内质子数为(2a2-1)
B.元素X形成的单质既能作氧化剂又能作还原剂
C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D.由元素X形成的某些化合物,可能具有杀菌消毒的作用
解析:选C。若a=1,则最外层电子数为3,不可能;若a=2,则X为氮元素;若a=3,则X为氯元素。C项,X为Cl时,Cl-的最外层电子数不满足2n2。
9.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是XH3<H2Y<HZ,下列说法中正确的是( )
A.原子序数:X>Y>Z
B.原子得电子能力:X<Y<Z
C.原子半径:X<Y<Z
D.离子还原性:X3-<Y2-<Z-
解析:选B。X、Y、Z三种元素位于同一周期,因氢化物稳定性XH3<H2Y<HZ,则非金属性为Z>Y>X,根据元素周期律,原子序数X<Y<Z,原子得电子能力为X<Y<Z,原子半径X>Y>Z,离子还原性X3->Y2->Z-。
8.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
解析:选B。由于aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则a-3=b-1=c+2=d+1,即形成阳离子元素的原子序数比形成阴离子元素的原子序数要大,且阳离子所带电荷越多,原子序数越大,阴离子所带电荷越少,原子序数越大。所以原子序数a>b>d>c,则A项不正确。另W、X、Y、Z在周期表中的相对位置为
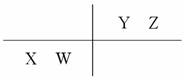
则Z的非金属性强于Y,其氢化物稳定性H2Y<HZ,故C项不正确。原子半径X、W的大小应为X>W,故D项不正确。由于Y的氧化性弱于Z,所以Y2-的还原性比Z-的还原性强,故B项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com