
题目列表(包括答案和解析)
8.下列变化为放热反应的是( )

A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量为862 kJ的化学反应
D.能量变化如图所示的化学反应
解析:选D。放热反应首先是化学反应,所以A错;一个化学反应有化学键的形成,还存在化学键的断裂,所以无法通过化学键形成所释放的能量大小来判断是放热反应还是吸热反应。
7.用CH4催化还原NOx可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ·mol-1
下列说法不正确的是( )
A.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH>-574 kJ·mol-1
B.反应①②转移的电子数相同
C.若用标准状况下4.48 L CH4还原NO2至N2同时生成气态水,放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol
解析:选A。水蒸气冷凝为液态水需要释放能量,所以CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1。
6.如图所示,a、b是两根石墨棒。下列叙述正确的是( )
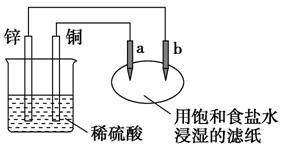
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.稀硫酸中硫酸根离子的物质的量不变
D.往滤纸上滴加酚酞试液,a极附近颜色变红
解析:选C。a是阳极,发生氧化反应;b是阴极,发生还原反应;在反应过程中,硫酸根离子没有参与反应,硫酸根离子的物质的量不变;往滤纸上滴加酚酞试液,b极附近颜色变红。
5.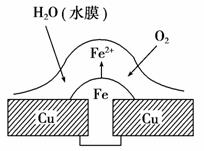 在铜器件上的铁铆钉(或铁螺丝)处容易发生腐蚀,如图所示。下列对该腐蚀的有关说法中,正确的是( )
在铜器件上的铁铆钉(或铁螺丝)处容易发生腐蚀,如图所示。下列对该腐蚀的有关说法中,正确的是( )
A.正极电极反应式:2H++2e-===H2↑
B.此过程中电子从铜器件流向铁铆钉
C.此过程中铜、铁都被腐蚀
D.负极电极反应式:Fe-2e-===Fe2+
解析:选D。铜器件与铁铆钉在表面水膜作为电解质溶液的情况下,形成原电池。正极反应为2H2O+O2+4e-===4OH-;负极反应为2Fe-4e-===2Fe2+;原电池中,电子由负极流向正极。
4.根据下列热化学方程式
(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
(2)H2(g)+O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
(3)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
解析:选B。该题应用盖斯定律,(1)×2+(2)×2-(3),可得ΔH=ΔH1×2+ΔH2×2-ΔH3=-488.3 kJ/mol。
3.电解硫酸铜溶液时,要求满足下列三点要求:①阳极质量逐渐减少;②阴极质量逐渐增加;③电解液中铜离子浓度不变。根据这三点要求可以选用的电极是( )
A.含有锌、银的铜合金作阳极,纯铜作阴极
B.含有锌、银的铜合金作阴极,纯铜作阳极
C.纯铁作阳极,纯铜作阴极
D.石墨作阴极,纯铜作阳极
解析:选D。选项D中,纯铜失电子而溶解,从而阳极质量变小;溶液中的铜离子在阴极石墨上析出,因此阴极质量增加;阴极析出铜的量等于阳极溶解铜的量,故溶液中的铜离子浓度不变。
2.已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是( )
A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
解析:选AB。任何一个化学反应,其反应前后都有能量的变化;在所给反应中,反应放热,则反应物的总能量高于生成物的总能量。
1.下列有关能量转化的说法正确的是( )
A.煤燃烧主要是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
解析:选AB。葡萄糖被氧化时放出热量,是化学能转变成热能,C错;将CO2转化为葡萄糖是太阳能转化为化学能,D错。
21.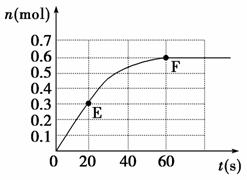 (12分)373 K时,某1 L密闭容器中发生如下可逆反应:A(g)
(12分)373 K时,某1 L密闭容器中发生如下可逆反应:A(g)  2B(g)。其中物质B的物质的量变化如图所示。
2B(g)。其中物质B的物质的量变化如图所示。
试填空:
(1)已知373 K时,60 s时达到平衡,则前60 s内A的平均反应速率为________。
(2)若373 K时B的平衡浓度为A的3倍,473 K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473 K时A的物质的量随时间的变化曲线。
(3)若反应在373 K进行,在1 L密闭容器中加入1 mol B、0.2 mol He,达到平衡时B的转化率应________。
A.等于60% B.等于40%
C.小于40% D.介于40%-60%之间
(4)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如作直线EF的斜率表示20 s-60 s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义
________________________________________________________
___________________________________________________________。
解析:(1)由图可知反应A(g) 2B(g),在60 s达到平衡时,生成B物质0.6 mol,则有0.3 mol A发生反应,则A的反应速率为=0.005 mol/(L·s)。
2B(g),在60 s达到平衡时,生成B物质0.6 mol,则有0.3 mol A发生反应,则A的反应速率为=0.005 mol/(L·s)。
(2)(3)根据373 K时B浓度是A浓度的3倍,B为0.6 mol/L,则A为0.2 mol/L,说明起始条件为0.5 mol A或1 mol B,此时B的转化率为40%。若加入1 mol B和0.2 mol He,则使压强增大,因为是恒容条件,稀有气体对平衡无影响,则转化率仍为40%。
答案:(1)0.005 mol/(L·s)
(2)见图
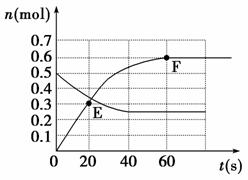
曲线注意两点:A的起始及平衡时的物质的量(分别为0.5 mol,0.25 mol),达到平衡所需时间应小于60 s。
(3)B
(4)某一时刻的反应速率(或即时速率、瞬时速率)
20.(12分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了a mol·L-1,又知平均反应速率:v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了a mol·L-1,又知平均反应速率:v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:
m=________,n=________,p=________。
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。
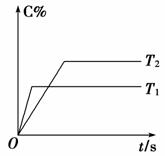
由此可知,该反应为 (填“吸热”或“放热”)反应。
(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
解析:(1)根据速率之比等于化学计量数之比,则m∶n∶p=3∶1∶2,故m=3,n=1,p=2。
(2)由图象可知T1>T2,升温C%减小,平衡逆向移动,说明正向放热。
(3)K=,升温K减小。
答案:(1)3 1 2 (2)放热
(3)K= 减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com