
题目列表(包括答案和解析)
16.1.92 g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
A.504 mL B.336 mL
C.224 mL D.168 mL
解析:选B。此题初审发现浓HNO3与Cu反应,产生NO2,当HNO3变稀产生NO,即672 mL气体不知道含NO2、NO各多少毫升,看似无从下手,但抓住反应本质Cu―→Cu2+,NOx+O2+H2O―→HNO3即Cu失电子数等于O2得电子数,则有:V(O2)=×2÷4×22400 mL/mol=336 mL
15.下列实验现象的描述错误的是( )
A.氢气在氯气中燃烧生成黄绿色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
解析:选A。H2在Cl2中燃烧,发出苍白色的火焰,并在瓶口产生大量白雾。原因是H2与Cl2反应生成的HCl气体与空气中的水蒸气结合生成盐酸小液滴而形成白雾。
14.水是生命之源,下列有关说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可以溶解Au、Pt
C.氨水能导电,说明氨气是电解质
D.新制备的氯水中存在三种分子、四种离子
解析:选D。双氧水被称为绿色氧化剂,是因为其还原产物为H2O,对环境无污染;王水是浓盐酸和浓硝酸按体积比3∶1配成的混合物;氨水能导电,但并不是NH3本身电离产生离子,故NH3为非电解质。
13. 0.96 g Mg跟含6.3 g HNO3的稀溶液恰好反应完全,则HNO3的还原产物的摩尔质量可能是( )
A.30 g·mol-1或46 g·mol-1
B.44 g·mol-1或80 g·mol-1
C.28 g·mol-1
D.46 g·mol-1
解析:选B。根据题意,n(Mg)==0.04 mol;n(HNO3)==0.1 mol。设HNO3的还原产物中N元素的化合价为+x价,则根据得失电子守恒,可得0.04×2=0.02×(5-x),解得x=1。由于在NH4NO3中N的平均化合价为+1价,故还原产物可能为N2O或NH4NO3,所以还原产物的摩尔质量可能为44 g·mol-1或80 g·mol-1。
12.无色混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体依次经过下图实验的处理,结果得到酸性溶液且最终无剩余气体。则甲气体的组成为( )
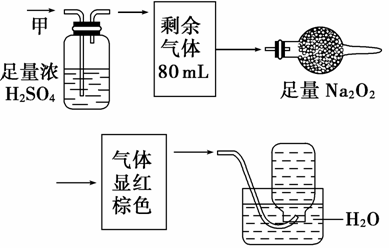
A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO、CO2、N2 D.NO、CO2、N2
解析:选B。通过浓H2SO4气体体积缩小,则一定含NH3,再通过Na2O2后,气体显红棕色,则一定有NO、CO2。最后无气体剩余,则一定无N2,原混合气体无色,则无NO2,故B项正确。
11.工业生产的生石灰中常混有二氧化硅和石灰石。现将该生石灰样品溶于过量的盐酸中。然后在不断搅拌(必要时可以加热)的情况下,向反应混合液中逐滴加入氢氧化钠溶液至过量,如果纵坐标表示固体难溶物的质量(m),横坐标表示所加入氢氧化钠溶液的体积(V),则下列图示正确的是( )
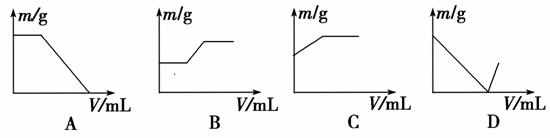
解析:选B。生石灰样品溶于过量盐酸后,溶液中的溶质为CaCl2和过量的HCl。滴加NaOH溶液时,NaOH首先与盐酸反应,所以开始时固体难溶物的质量无变化,C、D两选项不正确,当盐酸耗完后,SiO2开始溶解时,发生反应的离子方程式为:SiO2+2OH-===SiO32-+H2O,SiO32-+Ca2+===CaSiO3↓,依据两个方程式的系数关系可知,溶解1 mol SiO2(60 g)的同时生成1 mol难溶物CaSiO3(116 g),难溶物的质量增加。
10.在含2 mol H2SO4的浓H2SO4溶液中加入足量的锌粉,使其充分反应,下列推断中有错误的是( )
①放出的气体除SO2外还有H2
②只放出SO2气体,其物质的量为1 mol
③反应结束时转移的电子的物质的量为4 mol
A.① B.②
C.②③ D.①②
解析:选C。Zn与浓硫酸发生反应:Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,反应将变为:Zn+H2SO4(稀)===ZnSO4+H2↑,由于硫酸的总物质的量为2 mol,综合这两个反应可知,转移电子的物质的量应该介于2 mol到4 mol之间。转移电子的物质的量也可以借助Zn思考:结合这两个反应方程式,由于硫酸的总物质的量为2 mol,因而消耗的Zn的物质的量应该大于1 mol,小于2 mol。
9.已知:①在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝;②在上述蓝色溶液中,滴加过量的Na2SO3溶液,蓝色逐渐消失;③取实验②生成的溶液滴加BaCl2溶液有白色沉淀生成。下列判断正确的是( )
A.上述实验证明氧化性:ClO->I2>SO42-
B.上述实验③中的白色沉淀是BaSO4,一定不含有BaSO3
C.实验①中硫酸的作用是氧化性和酸性
D.实验②证明SO32-既有氧化性又有还原性
解析:选A。据题意有:ClO-+2I-+2H+===Cl-+I2+H2O;SO32-+I2+H2O===2I-+SO42-+2H+,所以可知氧化性:ClO->I2>SO42-,因为②中加入了过量的Na2SO3溶液,所以③中含有BaSO3沉淀;①中硫酸只起到酸性作用,②只能证明SO32-有还原性。
8.如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是( )
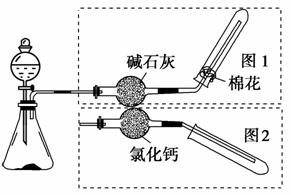
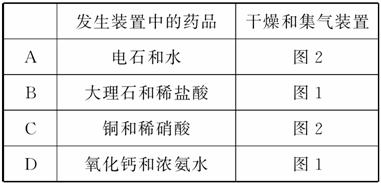
解析:选D。HCCH和NO必须用排水法收集,故A、C两项均不正确;CO2不能用碱石灰干燥,也不能用向下排空气法,故B项不正确;CaO和浓氨水反应生成NH3,可用碱石灰干燥,且可用向下排空气法收集,故D项正确。
7.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是( )
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含SO42-
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
解析:选A。B项Cl2氧化KI生成的I2遇淀粉变蓝,C项白色沉淀可能是AgCl,D项铜与冷的浓H2SO4不反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com