
题目列表(包括答案和解析)
4.“纳米材料”(1 nm=10-9m )是指研究开发直径为几纳米至几十纳米的材料。如将“纳米材料”分散到某液体中,对于所得分散系的叙述不正确的是( )
A.光束通过此分散系时会形成一条光亮的“通路”
B.此分散系中“纳米材料”的粒子在做不停的、无序的运动
C.在外加电场作用下,“纳米材料”的粒子可能向电极做定向运动
D.用滤纸过滤的方法可以从此分散系中分离得到该“纳米材料”
解析:选D。由于“纳米材料”的粒子直径是几纳米至几十纳米,即其直径大小在胶体粒子直径的范围内,所以将其分散到某液体中时形成的分散系是胶体,因而也就具有胶体的性质,如丁达尔效应、胶体的电泳以及能透过滤纸等性质,而布朗运动是粒子做无规则运动,胶体、溶液等都有此性质。
3.下列做法中用到物质氧化性的是( )
A.明矾净化水 B.纯碱除去油污
C.臭氧消毒餐具 D.食醋清洗水垢
解析:选C。臭氧具有强氧化性,能杀菌消毒。明矾净水是利用Al3+水解生成Al(OH)3胶体的性质;纯碱除去油污是利用了CO32-水解使溶液呈碱性的性质;食醋清洗水垢是利用了食醋的酸性。
2.不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A.都比较稳定,密封放置不产生沉淀
B.都有丁达尔现象
C.加入少量NaOH溶液都可产生沉淀
D.分散质微粒均可透过滤纸
解析:选B。溶液和胶体外观基本一致,一般为均一透明、稳定,A项正确;胶体能产生丁达尔现象而溶液不能,B错误;C项,向Fe(OH)3胶体中加入NaOH溶液,会使胶体发生聚沉,产生Fe(OH)3沉淀,而MgCl2与NaOH反应生成Mg(OH)2沉淀;D项,胶体和溶液的分散质粒子均可透过滤纸。
1.关于物质分类的正确组合是( )
|
分类 组合 |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
|
A |
Na2CO3 |
H2SO4 |
NaHCO3 |
SiO2 |
CO2 |
|
B |
NaOH |
HCl |
NaCl |
Na2O |
CO |
|
C |
NaOH |
CH3COOH |
MgCl2 |
Na2O2 |
SO2 |
|
D |
KOH |
HNO3 |
CaCO3 |
CaO |
SO3 |
解析:选D。A项中Na2CO3不是碱,SiO2不是碱性氧化物;B项中CO不是酸性氧化物,是不成盐氧化物;C中Na2O2不属于碱性氧化物,因为Na2O2与酸溶液反应,除生成盐和水外,还放出O2。
21.(14分)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
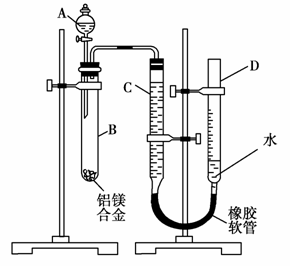
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________________________________________________
___________________________________________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);
记录C的液面位置时,除视线平视外,还应__________________。
(4)B中发生反应的化学方程式为__________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 。(填“偏大”、“偏小”、“不受影响”)
解析:解答第(1)小题应注意结合Mg和NaOH溶液不反应而Al与NaOH溶液反应这一差别,确定应选NaOH溶液。若选择稀酸则(5)步无法计算。
(2)镁、铝合金的表面易形成氧化膜,氧化膜的存在会使铝的质量分数和铝的相对原子质量的测定存在较大误差,同时也会造成NaOH溶液的浪费,所以实验前应先除去铝镁合金表面的氧化膜。
(3)结合本实验的特点和要求,不难分析出该实验操作步骤为:检密→记录→反应→记录→称重。
(4)镁和NaOH溶液不反应,铝和NaOH溶液反应的方程式为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(5)解答该小题可设铝的相对原子质量为M,然后依据电子得失守恒进行列式计算,即×3=×2,化简得:M=
(6)若不洗涤过滤得到的不溶物,就进行干燥称重的话,不溶物的表面可能附有NaAlO2和NaOH,使剩余固体质量偏大,即反应掉的铝的质量偏小。
答案:(1)NaOH溶液
(2)除去铝镁合金表面的氧化膜
(3)⑤①④③② 使D和C的液面相平
(4)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(5) (6)偏小
20.(8分)下图中A-J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
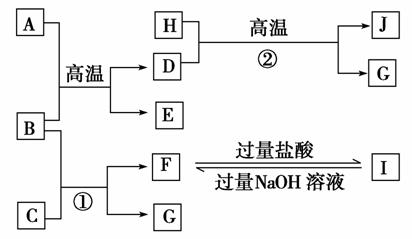
根据图示回答问题:
(1)写出下列物质的化学式:A ,E ,
I 。
(2)反应①的化学方程式是 ;反应②的化学方程式是 。
(3)J与盐酸反应的化学方程式是 ;反应后的溶液与D反应的化学方程式是_____________________________。
解析:B是地壳中含量最高的金属元素,说明B是金属铝,根据F与I之间的相互转化关系,可知F为钠盐,反推知C为NaOH,F是NaAlO2,I是AlCl3,G是H2。根据题意J是磁性材料,说明J是Fe3O4,反应是在高温下发生反应,产物是Fe3O4和H2,反推知单质D为Fe,H为H2O,A和B为高温下的铝热反应,A应该是铁的氧化物--Fe2O3或FeO。
答案:(1)Fe2O3(或是FeO) Al2O3 AlCl3
(2)2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 3Fe+4H2O(g)Fe3O4+4H2
(3)Fe3O4+8HCl===FeCl2+2FeCl3+4H2O 2FeCl3+Fe===3FeCl2
19.(12分)(2009年高考福建卷)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
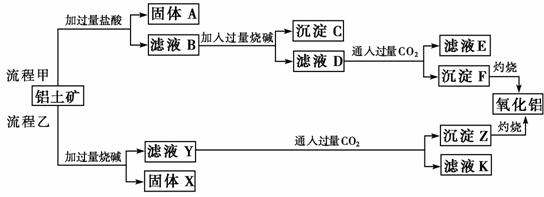
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为____________________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_____________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途____________________________________________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________________。
解析:流程甲为: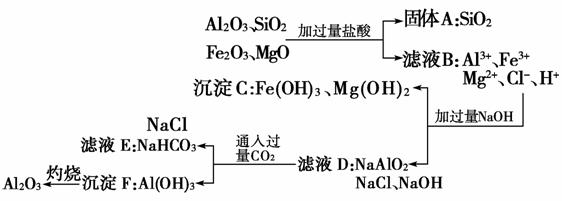
流程乙为:
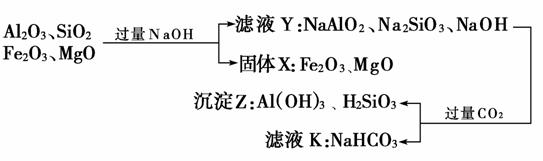
则滤液E、K中溶质的主要成分是NaHCO3,该物质可用于作发酵粉、制纯碱等。(5)由Mg(OH)2的溶度积常数Ksp=5.6×10-12=c2(OH-)·c(Mg2+)可推知:c(Mg2+)=mol·L-1=5.6×10-10mol·L-1。
答案:(1)Al2O3+6H+===2Al3++3H2O
(2)SiO2+2OH-===SiO32-+H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等)
(4)NaHCO3 制纯碱或作发酵粉等
(5)5.6×10-10 mol·L-1
18.(12分)将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是________,可能有的阳离子是________。(不考虑水电离出的H+,下同)
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是________,可能含有的阳离子是________。
(3)如果反应后的溶液中无金属剩余,则加入金属粉末的最大质量应小于________。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末的最小质量为________。
解析:本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe2+;②与Cu反应生成Cu2+;③与Fe2+反应生成Fe3+。所以,(1)若反应后有Cu剩余,则此溶液中一定有的是Fe2+,可能有的是Cu2+;(2)若反应后有Fe3+时,则此溶液中一定有的是Cu2+,可能有的是Fe2+;(3)由上述三个过程可知,只发生与铜的反应时所需的金属量最多,由3Cu-8HNO3可解得需Cu的质量为9.6 g;(4)因要求HNO3完全反应且金属质量最小,所以加入的铁要尽可能多耗酸,所以生成的是Fe3+,而Fe和Cu的质量比为7∶8,可得到两者的物质的量之比为1∶1,根据Fe→4HNO3,3Cu→8HNO3可解得需要Fe和Cu的物质的量均为0.06 mol,从而可得金属粉末的质量为7.2 g。
答案:(1)Fe2+ Cu2+ (2)Cu2+ Fe2+ (3)9.6 g
(4)7.2 g
17.(6分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1 mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A、B、E的化学式:A________、B_________、E____________。
(2)写出③和④的离子方程式:
③_____________________________________________________;
④_____________________________________________________。
解析:A和E的溶液显碱性,说明是碱溶液或者强碱弱酸盐溶液,形成碱溶液的阳离子有Na+和Ba2+,0.1 mol/L A溶液的pH小于13,说明A是盐,而题中弱酸根离子只有CO32-,则A是Na2CO3,E是碱,为Ba(OH)2。在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失,此为银氨溶液的配置过程,说明B溶液中存在Ag+,而与Ag+形成可溶性化合物的题中只有NO3-,则B是AgNO3。在C的溶液中加入铁粉,溶液的质量增加,说明铁粉被C溶液氧化,则C溶液中有Fe3+,为Fe2(SO4)3或者FeCl3,在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀,D中没有SO42-,进一步得出C是Fe2(SO4)3,则D是AlCl3。
答案:(1)Na2CO3 AgNO3 Ba(OH)2
(2)③2Fe3++Fe===3Fe2+
④Al3++4OH-===AlO2-+2H2O
16.证明某溶液含有Fe2+而不含有Fe3+的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,迅速变灰绿色,最后呈红褐色
D.只需滴加KSCN溶液
解析:选BC。如果先滴加氯水,Fe2+将被氧化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com