
题目列表(包括答案和解析)
1213.下列灭火技能用于扑灭金属钠着火的是( )
A.干冰 B.黄沙 C.干粉(含NaHCO3) D.泡沫灭火剂
1212. A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称: 。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
1211.向某二价金属M的氢氧化物的澄清溶液100mL中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25.0mL恰好与20.0mL盐酸完全反应并收集到1.12L(标准状况下)气体。
(1)若欲计算M的相对原子质量,你认为还必须提供下列哪组数据 。(填代号)
A.M的氢氧化物溶液的浓度(设为2.00mol/L)
B.MCO3沉淀的质量(设为39.4g)
C.与MCO3反应的盐酸的浓度(设为1.00mol/L)
D.题设条件充足,不需补充数据
(2)根据你的选择,计算M的相对原子质量和加入的NaHCO3溶液中含NaHCO3的质量。
(要有过程)
1210.为了测定已部分变质的过氧化钠样品的纯度,设计右图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开了漏斗的活塞,将稀硫酸滴入气球中。请填空:
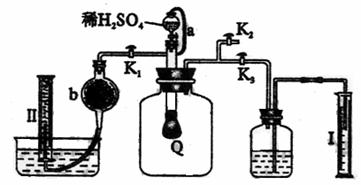
(1)Q内发生化学反应时,生成的气体是 。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是 ,应当打开的是 。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开
K1,这时可观察到的现象是 。
(4)b中装的固体试剂是 ,为什么要缓缓打开K1
。
(5)实验结束时,量筒I中有x mL水,量筒II中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是 (需化成最简表达式。
1209.高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。

①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是
。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(选填“100mL”“200mL”“500mL”或“1000mL”)。
1208.甲、乙、丙为常见单质,乙、丙两元素在周期中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如右图。
请回答:
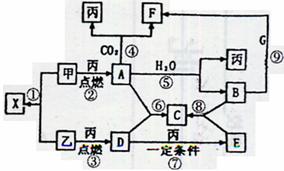 (1)用化学式表示:丙为
,E为
。
(1)用化学式表示:丙为
,E为
。
(2)X的电子式为 。
(3)写出A与H2O反应的化学方程式
(4)写出B与G溶液反应生成F的离子程式:
(5)在上图①-⑨的反应中,不属于氧化还原反应的是(填序号) 。
1207.将金属钾投入到硫酸铜溶液中,现象是
,有关的化学方程式为
。
1206.2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是( )
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
1205.某种干燥粉末混合物可能由Na2O、Na2CO3、、Na2O2、NaCl、NaHCO3中的两种或几种组成(假设固体混合时不反应)。若将其先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体不再发生,发现剩余固体的质量增加,则对原混合物的叙述正确的是( )
A.一定含有 B.一定含有
B.一定含有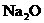 和NaCl
和NaCl
C.不含有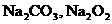 D.不含有
D.不含有
1202.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是( )
(1)H2 (2)CO (3)CO和H2 (4)HCOOCH3 (5)HOOC-COOH
A.全部 B.仅(4)(5) C.仅(1)(2)(3) D.除(5)以外 1203.向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有( )
A.NaNO2 NO H2O B.NaNO3 NaOH O2 H2O
C.NaNO3 H2O D.NaNO3 HNO3 O2 H2O 1204.下列溶液经反应后,溶液内含有0.50 mol NaHCO3和0.50 mol Na2CO3的是( )
A.0.50L 1.00 mol·L-1NaHCO3加0.50L 0.50 mol·L-1NaOH
B.0.50L 0.75 mol·L-1 Na2CO3加0.50L 0.50 mol·L-1 HCl
C.0.50L 1.00 mol·L-1 NaHCO3 加0.50L 0.25 mol·L-1 NaOH
D.1.00L 1.00 mol·L-1 Na2CO3 加1.00L 0.50 mol·L-1 HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com