
题目列表(包括答案和解析)
14.(2009·广东)下列浓度关系正确的是 ( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
解析:氯水中存在Cl2、HClO、Cl-、H+、OH-等微粒,Cl2与其它含氯元素的微粒间没有明确的定量关系,溶液中的电荷守恒关系为c(H+)=c(Cl-)+c(OH-)+c(ClO-),故A、B两项均不正确。C选项中NaOH与CH3COOH恰好完全反应生成CH3COONa,进一步水解使溶液显碱性,c(Na+)>c(CH3COO-)。
答案:D
13.(2009·全国卷Ⅰ)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是 ( )
A.c(NH)>c(Cl-),c(OH-)>c(H+)
B.c(NH)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH),c(OH-)>c(H+)
D.c(Cl-)>c(NH),c(H+)>c(OH-)
解析:据电荷守恒,在滴定后的溶液中存在c(NH)+c(H+)=c(Cl-)+c(OH-),因此不可能出现阴离子浓度都大于阳离子浓度的情况。
答案:C
12.(2009·天津)25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是 ( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO)均增大
解析:在浓度相等时,Na2CO3的水解程度大于NaHCO3,其溶液的c(OH-)?Na2CO3>NaHCO3。
答案:C
11.(2009·福建)在一定条件下,Na2CO3溶液存在水解平衡:CO+H2OHCO+OH-。下列说法正确的是 ( )
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,减小
D.加入NaOH固体,溶液pH减小
解析:A中K=稀释溶液,各离子浓度均减小,但同时平衡正向移动,使得该式子中分子减小的程度更大,故平衡常数减小。
C中水解吸热故升高温度,平衡正向移动,c(HCO)增大,c(CO)减小,则增大。
答案:B
10.(2009·启东模拟)某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是 ( )
A.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.加入适量的NaOH,溶液中离子浓度为 c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH)之和
答案:B
9.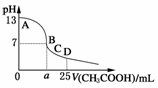 室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2
mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是 ( )
室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2
mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是 ( )
A.在A、B间任一点,溶液中一定都有 c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有 c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
答案:C
8.(2009·广东高考)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
答案:C
7.关于氯化铁水解的说法错误的是 ( )
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸
答案:C
6.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡 常数(25℃) |
1.75×10-5 |
6.2×10-10 |
K1=4.4×10-7 K2=4.7×10-11 |
则下列有关说法正确的是 ( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
答案:D
5.(2008·全国卷Ⅰ)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是 ( )
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com