
题目列表(包括答案和解析)
0.083 mol 0.125 mol
设三种金属的物质的量之和为n,则0.083 mol<n<0.125 mol,故选项C正确。
答案:C
0.125 mol =0.125 mol
若全部为Al,2Al+6HCl===2AlCl3+3H2↑
2 3
6.将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8 L(标准状况下),则这三种金属的物质的量之和可能为 ( )
A.0.250 mol B.0.125 mol
C.0.100 mol D.0.080 mol
解析:若全部为Mg、Zn,Mg、Zn为+2价金属由
R+2HCl===RCl2+H2↑
1 1
5.(2009·泰安)标准状况下有①0.112 L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是 ( )
A.体积:①④③② B.密度:④①③②
C.质量:①④③② D.氢原子数:②④③①
解析:先转化为物质的量,①n(H2O)==6.22 mol;②n(HCl)=0.5 mol;③n(H2S)==0.4 mol,则A项中体积由小到大排列为①④③②,正确;B项中密度最大的是①,C项中质量最小的为④。
答案:AD
4.(2009·济宁质量检测)设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.1 mol Cl2参加的任何反应,反应过程中转移电子数都是2 NA
B.常温常压下的33.6 L氯气与27g铝充分反应,转移电子数为3NA
C.标准状况下,1 L乙醇完全燃烧产生CO2分子的数目为×2
D.将10 mL质量分数为98%的浓H2SO4,用水稀释至100 mL,H2SO4的质量分数大于9.8%
解析:A.1 mol Cl2和NaOH溶液反应时,Cl2+2NaOH===NaCl+NaClO+H2O,转移的电子数为NA。
B.1.5 mol Cl2与27 g铝反应转移的电子数为3NA,只有在标准状况下33.6 L Cl2的物质的量才是1.5 mol。
C.标准状况下,乙醇为液体。
D.设98%的浓H2SO4密度为ρ1 g/mL,9.8%的H2SO4浓度为ρ2 g/mL。稀释到100 mL时质量分数为ω。根据稀释前后H2SO4质量守恒得:ρ1×10×98%=ρ2×100×ω,∴ω=9.8%·,由于ρ1>ρ2,ω>9.8%。
答案:D
[点评] 本题考查物质的组成特点,以及摩尔质量、阿伏加德罗定律的意义,要抓住概念的本身特征去理解。
3.在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是 ( )
A.当它们的体积和温度、压强均相同时,三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(Ne)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积V(O2)>V(Ne)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量m(H2)>m(Ne)>m(O2)
答案:B
2.(2009·安庆模拟)由A、CH4、H2组成的混合气体,当V(A)?V(H2)=7?24时混合气体的摩尔质量为16 g/mol,则A为 ( )
A.O2 B.CO
C.CO2 D.SO2
答案:D
1.(2009·北师附中模拟)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是 ( )
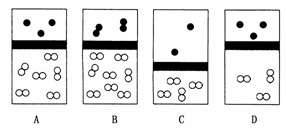
答案:A
18.(2009·江苏)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
盐酸 氢氧化钙 盐酸
工业CaCO3→→→→→
滤渣 CaCl2·2H2O
(1)除杂操作是加入氢氧化钙,调节溶液的PH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是______________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_____________________________________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________________________________。
②计算上述样品中CaCl2·2H2O的质量分数为______________________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______________________________________________;
________________________________________________________________________。
解析:第(1)问中若Fe(OH)3未沉淀完全则溶液中应含有Fe3+,但浓度很小所以通常选用KSCN而不用OH-检测;第(2)问中调节pH使之显弱酸性主要是为了防止Ca2+形成溶解度较小的Ca(OH)2、CaCO3;由Ag+-Cl-可知滴定溶液中,n(CaCl2·2H2O)=n(Cl-)=×0.05000 mol·L-1×20.39×10-3 L,
所以w(CaCl2·2H2O)=
×100%=99.9%。
答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,说明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管 ②99.9% ③样品中有少量的NaCl;少量CaCl2·2H2O失水
|

|
17.(2008·四川理综,26)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在 的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在 的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在 的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是__________。
解析:混合物溶于水得到无色溶液,说明混合物中没有CuSO4;焰色反应呈黄色,说明含有Na2SO4;白色沉淀加入稀盐酸,沉淀完全溶解,并放出气体说明不溶于HCl的白色沉淀BaSO4和AgCl,则白色沉淀是MgCO3,原溶液中没有Ba(NO3)2和AgNO3。
答案:(1)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2、AgNO3 |
MgCO3沉淀溶于稀盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失 |
(4)Al2(SO4)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com