
题目列表(包括答案和解析)
1.人类历史上大量生产和使用铝、钛、铁、铜四种金属的时间顺序是 ( )
A.铜、铁、铝、钛 B.铁、铝、铜、钛
C.铜、铁、钛、铝 D.铁、铜、铝、钛
解析:活泼性越强的金属在自然界中易以化合态存在,且因金属离子得电子能力较弱,生产和使用的时间往往就偏晚。Cu、Hg、Ag、Au、Sn、Pb等金属都是最早使用的几种金属,它们有的只以游离态存在,有的熔点很低易冶炼。在春秋晚期我们就会炼铁,战国晚期就会炼钢。铝在自然界中只以化合态存在,且工业上是通过电解氧化铝获得的,只在近代发明电以后才实现的。钛合金尽管有耐腐蚀、熔点高等优良的性能,但最大的缺点是提炼比较困难,因为钛在高温下可以与氧、碳、氮及其他许多元素化合,故钛使用时间最近。
答案:A
19.(探究创新题)某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O
该小组探究过程如下:
查阅资料:

提出假设:
(1)假设1:该混合金属粉末中除镁外还含有________元素
(2)假设2:该混合金属粉末中除镁外还含有________元素
(3)假设3:该混合金属粉末中除镁外还含有铝、锌元素
实验探究:
基于假设3,甲同学设计了如图1所示的实验方案,乙同学设计了如图2所示的实验方案:
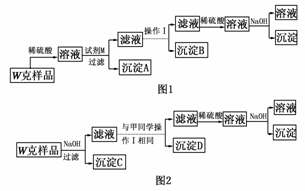
(1)试剂M是________。
(2)写出操作Ⅰ的过程________________________________________________
________________________________________________________________________。
(3)丙同学认为乙同学的方案比甲同学的好,理由是_________________________
________________________________________________________________________。
(4)丁同学研究了甲、乙两同学的方案后,用最简便的方法测定了W g样品中金属镁(Mg)的质量分数,他的方法是_______________________________________________
________________________________________________________________________。
答案:提出假设:(1)铝(或Al)
(2)锌(或Zn)(以上两空可颠倒)
实验探究:(1)NaOH溶液(或氢氧化钠溶液)
(2)在滤液中加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水
(3)步骤简单,节约试剂
(4)将沉淀C小心洗涤、干燥后称量、计算即可
18.(2009·六安模拟)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是________。(填序号)
A.铝与Cl-反应,铝与SO不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏铝表面氧化物薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是______________________。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是______________________________________
_____________________________________________________________________。
(4)某同学通过其他的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
解析:CuCl2与CuSO4溶液中均含有Cu2+,但CuSO4溶液不与铝片反应。故铝片与CuCl2溶液的反应一定是Cl-起到了破坏铝表面氧化物薄膜的作用。
CuCl2中的Cl-破坏掉氧化膜以后,Al能置换出CuCl2溶液中的Cu而使铝片表面呈暗红色,反应方程式为:2Al+3Cu2+===2Al3++3Cu。
因此设法除去铝表面的氧化物薄膜,或者往CuSO4溶液中加入Cl-均可使铝片与CuSO4溶液发生反应。
答案:(1)D (2)Cu
(3)H2 ①随着反应的进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解
(4)A、B、D
17.A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
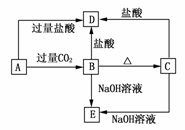
(1)写出化学式:A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B:________________________________________________________________________;
A→D:________________________________________________________________________。
解析:本题的突破口应在B、C两物质上,只要推断出B、C,其他物质的推断就很容易了。在短周期元素的化合物中,既能与盐酸反应,又能与NaOH溶液反应的,必为两性物质,又因为BC,故可知C为Al2O3,B为Al(OH)3,依次推出D是AlCl3,A与过量CO2反应生成Al(OH)3,且A溶液的焰色反应为浅紫色,则A为KAlO2,E为NaAlO2。相应的化学反应方程式也不难写出。
答案:(1)KAlO2 Al(OH)3 Al2O3 AlCl3 NaAlO2
(2)AlO+CO2+2H2O===Al(OH)3↓+HCO
AlO+4H+===Al3++2H2O
16.(2009·福建)某研究性小组借助A-D的仪器装置完成有关实验。
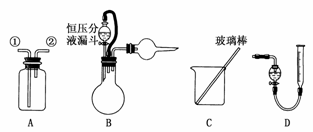
[实验一]收集NO气体
(1)用装置A收集NO气体,正确的操作是________(填序号)
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH===Na2ZnO2+H2↑,据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为V L(标准状况),则ω(Zn)=________。
(4)计算镀层厚度,还需要检索的一个物理量是________。
(5)若将装置B的恒压分液漏斗改为普通分泌漏斗,测量结果将________(填“偏大”“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2 g。
(6)ω(Zn)=________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙________(填“优于”“劣于”或“等同于”)方案乙。
解析:(1)NO的相对分子质量为28,和空气平均相对分子质量接近,故不能用排空气法收集,而NO不溶于水,可用排水法收集,则洗气瓶中气流方向为从导气管短的一端进入,所以选c。
(2)方案甲中要测定收集的H2的体积只能用D装置。
(3)由Zn - H2
1 1
mol mol
得w(Zn)===。
(4)由m(Zn)=ρ(Zn)·V=ρ(Zn)·S·d厚度可知,m、S已知,要求d厚度,则必须知道ρ(Zn)。
(5)若为普通分液漏斗,随着H2的增多,漏斗内气体压强增大,使得液面上升的高度增大,从而使V(H2)偏大。
(6)方案乙中加试样和碱反应,由于试样中的铁不与NaOH反应,故剩余质量为铁的质量,则(m1-m2)为锌的质量,w(Zn)=。
答案:(1)c (2)D (3)(或等其他合理答案)
(4)金属锌的密度(或其他合理答案) (5)偏大
(6)(若其他合理答案) (7)劣于
15.(2009·四川)向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是 ( )
A.c= B.p=m+
C.n=m+17Vc D.m<p<m
解析:KOHc mol/L、V mL
由流程图可知,n (H+)=2n(SO)=n(OH-)=c·V×10-3mol,又根据H元素守恒可知·2=cV×10-3,即c=,A项正确。最终灼烧产物为MgO和Al2O3,其质量可看作原金属单质质量和氧元素质量之和,则p=m+cV×10-3×16×=m+,故B项正确。C中n为Mg(OH)2和Al(OH)3总质量,可以看成是金属单质质量和OH-质量之和,即n=m+Vc×10-3×17,故C项错误。
答案:C
14.(2009·广东高考)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是 ( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
答案:A
13.(2009·滁州模拟)把铝粉和氧化亚铁粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸起反应;另一份放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是 ( )
A.1:1 B.2:3
C.3:2 D.28:9
解析:铝热剂的第一种反应过程:
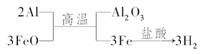
第二种反应过程:

故两种情况下生成H2的质量比为1:1。
答案:A
5.1 g+17 g·mol-1×0.5 mol=13.6 g。
答案:C
12.(2009·芜湖模拟)镁铝合金5.1 g溶于300 mL 2 mol/L的盐酸,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为 ( )
A.5.1 g B.10.2 g
C.13.6 g D.15.3 g
解析:0.6 mol HCl足可以使5.1 g Mg-Al合金完全溶解,共失电子×2=0.5 mol,即5.1 g镁、铝离子正电荷总物质的量为0.5 mol,沉淀时结合OH- 0.5 mol,故沉淀质量为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com