
题目列表(包括答案和解析)
9.(2009·哈师大附中模拟)硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,溴水褪色,乙变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是 ( )
A.SO3 H2SO4 H2SO3 H2S S
B.SO2 H2SO3 H2SO4 SO2 SO3
C.SO3 H2SO4 H2SO3 SO2 Na2S2O3
D.SO2 H2SO3 H2SO4 H2S S
答案:D
8.下列实验报告记录的实验现象正确的是 ( )
|
实验 |
 |
||||
|
记 录 |
A |
无色 |
无色 |
无现象 |
无色溶液 |
|
B |
红色 |
无色 |
白色沉淀 |
白色沉淀 |
|
|
C |
红色 |
无色 |
无色溶液 |
白色沉淀 |
|
|
D |
无色 |
无色 |
无色溶液 |
无色溶液 |
答案:B
7.下列溶液中能够区别SO2和CO2气体的是 ( )
①澄清石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④
C.除①以外 D.全部
答案:C
6.下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
答案:D
5.(2009·福建三校联考)将SO2和X气体分别通入BaCl2溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是 ( )
A.CO2 B.NH3
C.Cl2 D.H2S
答案:A
4.(2009·皖南模拟)在北京奥运会之前北京市实行机动车按照单双号行驶,此举既保障了交通秩序,又大大减少了空气污染。汽车尾气中所含污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有 ( )
A.氮气 B.硫化氢
C.二氧化硫 D.氮氧化合物
答案:D
3.(2008·广东广州4月)关于第ⅥA族和第ⅦA族元素的下列说法中正确的是( )
A.在同一周期,第ⅥA族元素氢化物的稳定性比第ⅦA族的强
B.浓度都是0.01 mol·L-1时 ,硫酸溶液的pH比高氯酸溶液的小
C.第ⅦA族单质的氧化性均比第ⅥA族单质的氧化性强
D.加热时,硫酸钠比氯酸钠易分解
解析:A项,同周期元素,第ⅦA族形成的氢化物最稳定,因为同周期元素的非金属性第ⅦA族最强;B项,H2SO4为二元强酸,HClO4为一元强酸;C项,如I2的氧化性比O2弱;D项,Na2SO4比NaClO3稳定。
答案:B
2.(2008·淄博第一次摸底)2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是 ( )
A.用“绿色化学”工艺,使原料完全转化为产物
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药、化肥提高粮食产量
解析:大量使用农药化肥提高粮食产量不利于节能降耗、保护环境。
答案:D
1.(2008·盐城)近期北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是 ( )
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S===2H++S2-
解析:硫化氢分子在300℃左右可以分解为H2和S,A错误。B选项H元素原子最外层只有2个电子,B选项错误。硫化氢是弱电解质,电离时要分2步电离,并且要用可逆符号来连接,D错误。
答案:C
18.(2009·天津)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列,从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:______________、____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为________________________________________________________________________
________________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为______________________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料;Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
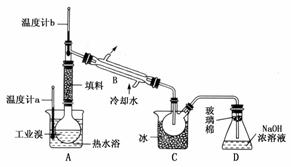
请你参与分析讨论:
①图中仪器B的名称:________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是________________________________________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________________________________________________________________。
解析:(1)海水淡化的方法主要有蒸馏法、离子交换法。
(2)电解NaCl溶液可生成H2、Cl2、NaOH,若将Cl2通入到NaOH溶液中可得到NaClO。
(3)步骤Ⅰ是为了富集海水中的溴。
(4)反应为SO2+Br2+2H2O===SO+2Br-+4H+,因生成强酸会对设备产生严重的腐蚀。
(5)②Br2会腐蚀橡胶。③控制温度(Br2的沸点为59℃)。④C中收集的是液溴(红棕色),通入Cl2后,Cl2+2NaBr===Br2+2NaCl,可用分液法操作分离。
答案:(1)蒸馏法、电渗析法、离子交换法(任填两种,其他合理答案即可)
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O===4H++SO+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分 ④深红棕色 分液(或蒸馏)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com