
题目列表(包括答案和解析)
2.据国外资料报道,在一种共生矿--独居石中,查明有尚未命名的116号元素,判断116号元素应位于周期表中的( )
A.第6周期ⅣA族 B.第7周期Ⅶ族
C.第7周期ⅥA族 D.第8周期ⅥA族
解析:第7周期稀有气体原子序数为118,则118-116=2,所以该元素应位于第7周期ⅥA 族。
答案:C
1.(2009·安徽师大附中)金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。下列有关Ti和Ti的说法中正确的是( )
A.Ti和Ti原子中均含有22个中子
B.Ti和Ti核外均有4个电子层
C.分别由Ti和Ti组成的金属钛单质互称为同分异构体
D.Ti与Ti为同一核素
解析:Ti和Ti原子中所含中子数分别为26、28,A项错误;Ti和Ti原子所含的质子数相同,核外电子数相同,电子层数相同,B项正确;同分异构体是指分子式相同,结构不同的化合物,C项错误;Ti和Ti原子的质子数相同,中子数不同,是同一种元素的不同核素,D项错误。
答案:B
22.(2009·福建卷)某研究性学习小组借助A-D的仪器装置完成有关实验。
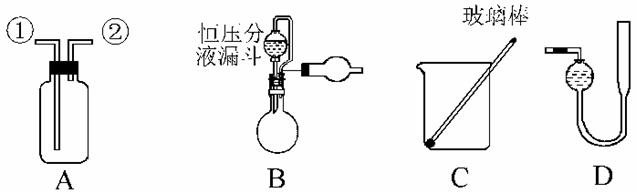
[实验一]收集NO气体。
(1)用装置A收集NO气体,正确的操作是__________(填序号)。
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH===Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水做试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实验探究目标。
(2)选用B和__________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为V L(标准状况),w(Zn)=__________。
(4)计算镀层厚度,还需检索的一个物理量是________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将__________(填“偏大”“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干、称得其质量为m2 g。
(6)w(Zn)=__________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙__________方案乙(填“优于”“劣于”或“等同于”)。
解析:本题考查定量化学实验。(1)常温下NO与氧气发生反应,故不能用排空气法收集。排水法收集气体应注意导管的“短进长出”。(2)B为制取气体的反应装置,而D为量气装置。(3)根据化学方程式,Zn的物质的量等于氢气的物质的量,w(Zn)=×65 g/mol÷m1=。(4)已知面积,计算其厚度需要体积即可,Zn质量可以计算,因此需要检索的物理量为密度。(5)恒压分液漏斗改为普通分液漏斗,则气体发生装置中的气压高于大气压,则D装置读数偏大。(6)两次质量差即为反应的Zn的质量。(7)方案丙中由于反应放热,导致溶液中水蒸发,从而致使测定结果误差较大。
答案:(1)c (2)D
(3)(或等其他合理答案)
(4)金属锌的密度
(5)偏大
(6)(或其他合理答案)
(7)劣于
21.已知某白色粉末只有K2SO4、NH4HCO3、KCl、NH4Cl、CuSO4五种物质中的两种,为检验该白色粉末的成分,请完成下列实验:
实验一:取适量该白色粉末于烧杯中,加蒸馏水溶解,得到无色透明溶液A。将溶液A分成两份,分别装于两支试管中,向其中一支试管里滴加稀硝酸,有无色气泡产生。
由此判断,该白色粉末中肯定含有__________,肯定不含有__________。
实验二:
|
待检验物质 |
实验操作 |
预期现象和结论 |
|
K2SO4 |
向盛有溶液A的另一支试管中滴加__________溶液 |
|
实验三:
|
实验前提 |
实验操作 |
预期现象和结论 |
|
若白色 粉末中不 含K2SO4 |
取少量原固体混合物于试管中,用酒精灯充分加热 |
如果试管底部有固体残留,则混合物中含有________;如果试管底部无固体残留,则混合物中含有__________ |
答案:实验一:NH4HCO3 CuSO4
实验二:BaCl2 若出现白色沉淀,则含有K2SO4
实验三:NH4HCO3和KCl NH4HCO3和NH4Cl
20.高锰酸钾俗称PP粉,为强氧化剂,遇到有机物就放出活性氧。这种氧有杀灭细菌的作用,且杀菌能力极强。某学生欲在实验室配制1 L 0.06 mol/L KMnO4稀溶液,用来清洗伤口。
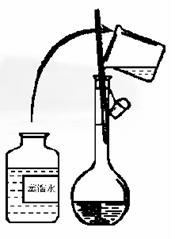
(1)实验过程中需用托盘天平称取KMnO4晶体的质量为__________g。
(2)其操作步骤如下图所示,则右图所示操作应在下图中__________(填选项字母)之间。
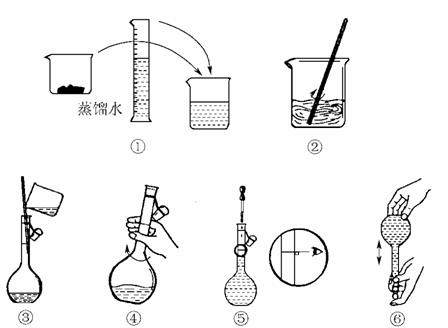
A.②与③ B.①与② C.④与⑤
(3)若该同学在配制溶液时,进行了如下操作,其中使所配溶液浓度偏低的操作有__________(填选项字母)。
A.称量KMnO4晶体时,指针偏向右边
B.将KMnO4晶体放在烧杯中溶解,冷却后,转移至含有少量蒸馏水的容量瓶中
C.定容时,仰视刻度线
D.振荡摇匀后,发现溶液液面低于刻度线,再滴加少量蒸馏水至刻度线处
解析:m(KMnO4)=1×0.06×158=9.48(g)≈9.5 g。
答案:(1)9.5 (2)C (3)ACD
19.某同学为了测定三聚氰胺的分子式,设计了如下实验:
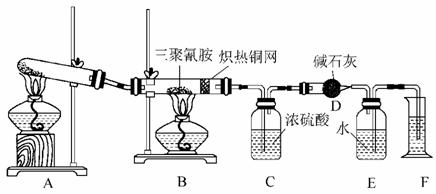
查阅资料,三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。取12.6 g三聚氰胺晶体按图示实验反应(假设三聚氰胺完全转化成产物)。
(1)写出A装置中发生反应的化学方程式________________________________________。
(2)C装置能不能与D装置互换?__________(填“能”或“不能”)。理由是____________________________。
(3)当B装置中反应完全发生后,读取F中水的体积的实验操作顺序为__________(填序号)。
①读数 ②冷却至室温 ③调平E、F装置中的液面
(4)测定数据如下:
|
装置 |
C |
D |
|
实验前 |
101.0 g |
56.0 g |
|
实验后 |
106.4 g |
69.2 g |
经测定,E中收集的气体折合成标准状况下的体积为6.72 L。
①利用上述实验数据,计算三聚氰胺的实验式为__________。
②三聚氰胺分子式为__________。
③若B装置中没有铜网,对测定结果的影响是__________________________________。
解析:(1)根据实验原理知:A装置用于制取氧气,且采用加热固体的方法制氧气;(2)碱石灰既能吸收二氧化碳又能吸收水,而浓硫酸只吸收水,不能吸收二氧化碳;(4)C装置增加的质量就是水的质量,D装置增加的质量就是二氧化碳的质量,n(CO2)=(69.2-56.0) g/44 g/mol=0.3 mol,n(H2O)=(106.4-101.0) g/18 g/mol=0.3 mol,n(N2)=6.72 L/22.4 L/mol=0.3 mol。则反应物中C、H、N元素的总质量=0.3 mol×12 g/mol+0.6 mol×1 g/mol+0.6 mol×14 g/mol=12.6 g,说明样品不含氧元素。所以三聚氰胺分子中,n(C)∶n(H)∶n(N)=0.3 mol∶0.6 mol∶0.6 mol=1∶2∶2,设三聚氰胺的分子式为(CH2N2)n,则(12+2+28)n=126,n=3,故其分子式为C3H6N6。若B装置中没有铜网,可能有没有反应的氧气进入E瓶中,导致测定的氮气体积偏大,即测定得到的三聚氰胺分子式中氮原子数偏大,而碳、氢原子数偏小。
答案:(1)2KMnO4△K2MnO4+MnO2+O2↑或2KClO3MnO2△2KCl+3O2↑ (2)不能 实验中浓硫酸吸收水,碱石灰吸收二氧化碳,若互换,碱石灰能同时吸收二氧化碳和水,导致实验失败 (3)②③① (4)CH2N2 C3H6N6 使测定所得的三聚氰胺分子式中氮原子数偏大,碳、氢原子数偏小
18.实验室用质量分数为98%、密度为1.84 g/cm3的浓硫酸配制100 g 10%的H2SO4溶液。配制过程中需要用到的仪器有( )
①托盘天平 ②10 mL量筒 ③100 mL量筒 ④烧杯 ⑤玻璃棒 ⑥100 mL容量瓶 ⑦胶头滴管
A.②③④⑤⑦ B.②④⑤⑥⑦
C.①④⑤⑥⑦ D.②③④⑤⑥⑦
解析:将一定体积的浓H2SO4稀释配制一定质量分数的溶液,不需要容量瓶。
答案:A
第Ⅱ卷(非选择题,共46分)
17.下列物质分离过程中涉及共价键断裂的是( )
A.用渗析法除去淀粉胶体中的少量NaCl
B.用饱和食盐水洗去Cl2中的少量HCl
C.用CCl4萃取碘水中的碘
D.用升华法除去NaCl中混有的少量碘
解析:A项利用NaCl能透过半透膜而胶体不能透过的性质;B项HCl在溶解的过程中断裂了共价键;C项仅是碘在CCl4中溶解;D项碘升华的过程中破坏的是分子间作用力。
答案:B
16.下列说法正确的是( )
A.苯酚沾在手上,应立即用NaOH溶液清洗
B.给试管中液体加热时,液体不超过试管容积的1/3
C.用升华法分离碘和氯化铵的混合物
D.试管壁上的银镜可用稀硫酸洗涤
解析:苯酚沾在手上,应立即用酒精清洗,A选项错误;加热碘升华,氯化铵分解,遇冷碘凝华,NH3与HCl化合成NH4Cl,故两者不能分离,C选项错误;试管壁上的银可用稀HNO3洗涤,D选项错误。
答案:B
15.将Mg、Al、Zn组成的混合物与足量盐酸作用,放出H2的体积为2.8 L(标准状况下),则三种金属的物质的量之和可能为( )
A.0.250 mol B.0.125 mol
C.0.100 mol D.0.080 mol
解析:氢气物质的量为 mol=0.125 mol。若全部为Mg或Zn,金属的物质的量为0.125 mol;若全部为Al,金属的物质的量为0.083 mol,故金属物质的量之和在0.083到0.125 mol之间。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com