
题目列表(包括答案和解析)
2.下面有关硅的叙述中,正确的是( )
A.硅的非金属性比碳弱,在高温下也不能跟氢气起化合反应
B.硅是构成矿物和岩石的主要元素,在地壳中的含量在所有元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是最重要的半导体材料
解析:硅在常温下化学性质很稳定,但在加热或高温下能与非金属氧气、氢气、氯气化合;硅在地壳中含量仅次于氧,排在第二位;在自然界以化合态存在;硅是大家熟悉的半导体材料。
答案:D
1.(2010辽宁沈阳检测)下列说法摘自一些科普杂志或广告用语,你认为有科学性错误的是( )
A.所有养料最终只有变成溶液,才能被动植物吸收
B.酸中毒病人输液时不应采用0.9%的氯化铵溶液
C.“白雪磷”漂白粉,令所有化学物质黯然失“色”
D.硅的提纯与应用促进了半导体元件与集成芯片事业的发展
解析:B.NH4Cl显酸性;C.“所有”错,如Au。
答案:C
11.孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)。
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4∶1;石青则为3∶1。请推算它们的化学组成。
孔雀石:_____________;石青:__________________________。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g。试通过计算确定该混合物中孔雀石和石青的物质的量之比。
解析:(1)xCuCO3·yCu(OH)2+2(x+y)HCl====(x+y)CuCl2+xCO2↑+(x+2y)H2O
孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4∶1,则有:
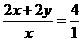 ,解得x∶y=1∶1,孔雀石的化学组成为CuCO3·Cu(OH)2。
,解得x∶y=1∶1,孔雀石的化学组成为CuCO3·Cu(OH)2。
石青消耗的盐酸的物质的量与生成的CO2的物质的量之比为3∶1,则有:
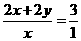 ,解得x∶y=2∶1,则石青的化学组成为2CuCO3·Cu(OH)2。
,解得x∶y=2∶1,则石青的化学组成为2CuCO3·Cu(OH)2。
(2)设该样品中孔雀石(CuCO3·Cu(OH)2)的物质的量为x,石青(2CuCO3·Cu(OH)2)的物质的量为y,则:
根据C元素守恒有:
x+2y=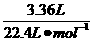 =0.15 mol
①
=0.15 mol
①
根据Cu元素守恒有:
2x+3y=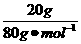 =0.25 mol
②
=0.25 mol
②
联立①②解得x=0.05 mol,y=0.05 mol,
孔雀石和石青的物质的量之比为1∶1。
答案:(1)CuCO3·Cu(OH)22CuCO3·Cu(OH)2 (2)2∶1
10.(2010山东济宁高三模拟)对CO和CO2的混合气体进行间歇性分离及干燥的实验装置,设计如图7-1:
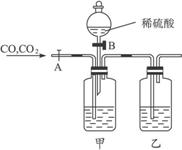
图7-1
(1)上图装置中,甲瓶中所盛的溶液是_____________,乙瓶所盛的溶液是_______________。
(2)当两个活塞_____________(填“A”或“B”)处于开启,_____________ (填“A”或“B”)处于关闭状态时,导入的混合气体可先分离得到干燥的_____________气体;然后当两个活塞分别变为_____________ (填“A”或“B”)处于开启,_____________(填“A”或“B”)处于关闭状态时,可分离得到干燥的_____________气体,此时有关反应的离子方程式为____________。
(3)上述操作得到的气体均不够纯净,其主要原因是_________________________________。
解析:注意甲瓶中溶液应为碱,但由于Ca(OH)2的溶解度不大,不宜选用,应使用NaOH溶液。
答案:(1)NaOH溶液或KOH溶液 浓硫酸
(2)A B CO
B A CO2 2H++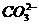 ====H2O+CO2↑
====H2O+CO2↑
(3)实验起初装置中的空气没有被提前排出,所以分离得到的CO气体中会混有空气;当分离CO2气体时,装置中CO气体又会混入到CO2气体中
9.正常情况下,大气中含有约78%的N2,21%的O2,还含有少量的CO2、水蒸气以及稀有气体和杂质。如果大气中CO2的含量明显增加,就会引起“温室效应”,导致全球变暖。
(1)CO2是共价化合物,它的电子式可表示为_________________________________。
(2)实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,产生的实验现象是____________________________,相应的反应方程式为_________________________。
(3)在宇宙飞船和太空站上工作的宇航员,在密闭的工作舱内需要吸入O2,呼出CO2,飞船内可以使用一种物质,它能吸收CO2并产生O2,该物质是_______________,其反应方程式为____________________________。
解析:本题主要考查了CO2的分子结构和性质。CO2作为化学与生物学相互联系的重要物质,在今后的综合测试中应引起重视。第1小题根据CO2为共价化合物,及C、O的原子结构可以写出电子式。第2小题中CO2通入澄清石灰水会使其变浑浊。第3小题中Na2O2和CO2反应会放出O2,可以供给宇航员呼吸。
答案:(1)
(2)变浑浊 CO2+Ca(OH)2====CaCO3↓+H2O
(3)Na2O2 2CO2+2Na2O2====2Na2CO3+O2
8.根据锡、铅的主要化合价及其稳定性,完成下列填空:
(1)锡的+2价化合物应具有较强的__________性,铅的+4价化合物应具有较强的__________性。
(2)已知Sn2+的还原性比Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
①氯气与锡共热_____________________________________;
②氯气与铅共热_____________________________________;
③PbO2与浓盐酸共热_________________________________。
④把棕色的PbO2投入亚硫酸溶液中充分反应,可观察到棕色PbO2逐渐变成白色固体物质____________________________________。
解析:稳定性: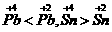 ;氧化性:
;氧化性: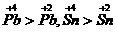 ,
,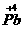 (PbO2)>Cl2>
(PbO2)>Cl2>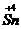 ;还原性:Fe2+<
;还原性:Fe2+<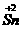 。根据氧化还原反应规律可写出有关反应方程式。
。根据氧化还原反应规律可写出有关反应方程式。
答案:(1)还原 氧化
(2)①Sn+2Cl2 SnCl4
SnCl4
②Pb+Cl2 PbCl2
PbCl2
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④PbO2+H2SO3====PbSO4↓+H2O
7.C和CaCO3的混合物在空气中强热后,C被完全氧化,CaCO3完全分解,若生成的CO2和原混合物的质量相等,则原混合物中单质碳的质量分数为( )
A.17.35% B.27.71% C.35.24% D.42.63%
解析:C燃烧后,产物是CO2,CaCO3强热分解,产物也有CO2,利用常规方法此题不难求解。此外,我们还可以根据在反应前后碳元素的质量守恒来解这道题,角度更新、方法更简便。
设混合物为100 g,其中含单质碳的质量为x,
所以x+(100-x)×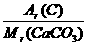 =100×
=100×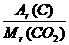
x+(100-x)×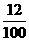 =100×
=100×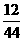
x=17.35 g
所以w(C)=17.35%。
答案:A
6.某二价金属的碳酸盐和碳酸氢盐的混合物跟足量盐酸反应时消耗的H+和产生CO2的物质的量之比为5∶4,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.4∶5
解析:设二价金属为M,混合物中碳酸盐(MCO3)和碳酸氢盐(M(HCO3)2)的物质的量分别为x和y,由题意可知:
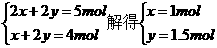
x∶y=2∶3
答案:B
5.(2010北京东城检测)能说明碳元素的非金属性比硅元素强的是( )
A.甲烷比硅化氢稳定 B.碳与SiO2反应生成硅
C.硅酸与碳酸钠溶液反应生成碳酸 D.高温下SiO2和Na2CO3反应
解析:元素非金属性的比较,可以从其气态氢化物的稳定性来比较,也可以从最高价氧化物对应水化物的酸性强弱来比较。当然还有其他比较方式。由此看A正确。
答案:A
4.可以肯定溶液中大量存在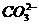 的理由是( )
的理由是( )
A.加入AgNO3溶液,有大量白色沉淀产生
B.加入酸,有无色无味气体产生
C.加入BaCl2溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味的气体
D.加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸如C所述
解析:溶液中含有Cl-、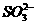 时,可与AgNO3溶液反应产生白色沉淀,A不正确。
时,可与AgNO3溶液反应产生白色沉淀,A不正确。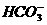 与酸反应会产生无色无味CO2气体,B不正确。向含有
与酸反应会产生无色无味CO2气体,B不正确。向含有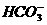 的溶液中加入Ba(OH)2时:
的溶液中加入Ba(OH)2时: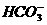 +OH-+Ba2+====BaCO3↓+H2O,再加盐酸BaCO3+2H+====Ba2++CO2↑+H2O,其现象与
+OH-+Ba2+====BaCO3↓+H2O,再加盐酸BaCO3+2H+====Ba2++CO2↑+H2O,其现象与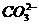 反应现象相同,D选项不正确。
反应现象相同,D选项不正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com