
题目列表(包括答案和解析)
6.某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25 ℃时,将a g该晶体溶于b g水中恰好可形成V mL饱和溶液。下列关系正确的是( )
A.饱和溶液的物质的量浓度c=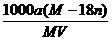 mol·L-1
mol·L-1
B.饱和溶液中溶质的质量分数w=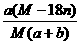 %
%
C.25 ℃时R的溶解度S=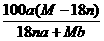
D.饱和溶液的密度ρ= g·L-1
g·L-1
解析:A项,晶体的物质的量等于无水物的物质的量。
c(R)=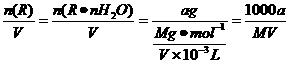 mol·L-1
mol·L-1
B项,w=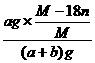 ×100%=
×100%=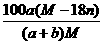 %
%
C项,
D项,ρ=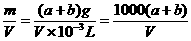 g·L-1
g·L-1
答案:C
5.(2010天津高考理综,11)在一定温度下,某无水盐R在水中溶解度为23 g,向R的饱和溶液中加入B g该无水盐,保持温度不变,析出R的结晶水合物W g,从原饱和溶液中析出溶质R的质量为( )
A.(W-B)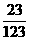 g
B.(W-B)
g
B.(W-B)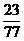 g
g
C.(W-B)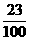 g
D.(W-
g
D.(W-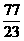 B) g
B) g
解析:加入的B g无水盐显然不能溶解,它结合部分水生成结晶水合物,所以,析出更多的R。假设析出W g水合物中R的质量为x,则从溶液中析出R的质量为(x-B g)。可知,(x-B g) R应正好溶于(W g-x)水中,形成饱和溶液。所以,
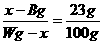 ,
,
解得x= g。
g。
所以析出晶体质量为x-B g=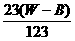 g,正确答案为A。
g,正确答案为A。
答案:A
4.(2010广东广州期末卷)在一定温度下,b g固体A能完全溶于水中形成(a+b) g 溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解度肯定不可能的是( )
A.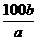 g
B.
g
B.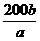 g
C.
g
C. g
D.
g
D.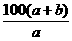 g
g
解析:b g固体A能完全溶于水形成(a+b) g溶液,设恰好形成饱和溶液,则 ,S=
,S=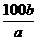 ,若不形成饱和溶液,则S>
,若不形成饱和溶液,则S>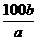 ,则A、B、D可以。
,则A、B、D可以。
答案:C
3.100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中 的物质的量浓度约为( )
的物质的量浓度约为( )
A.0.2 mol·L-1 B.0.25 mol·L-1 C.0.4 mol·L-1 D.0.5 mol·L-1
解析:混合溶液中 的总物质的量为:0.1 L×0.3 mol·L-1+0.05 L×0.2 mol·L-1×3=0.06 mol。混合溶液的体积约为两溶液体积之和,即V(aq)=150 mL。c(
的总物质的量为:0.1 L×0.3 mol·L-1+0.05 L×0.2 mol·L-1×3=0.06 mol。混合溶液的体积约为两溶液体积之和,即V(aq)=150 mL。c( )=
)=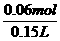 =0.4 mol·L-1。
=0.4 mol·L-1。
答案:C
2.“纳米材料”是直径为几纳米至几十纳米的材料(1 nm=10-9 m)。其研究成果已应用于医学、军事、化工等领域。如将“纳米材料”分散到水中,得到的分散系不可能具有的性质是( )
A.能全部通过半透膜 B.能全部通过滤纸
C.有丁达尔效应 D.有电泳现象
解析:胶体粒子的直径为10-9-10-7 m,“纳米材料”的直径正好处在这一范围,因此,“纳米材料”分散在水中应具有胶体的性质。因为胶体粒子不能通过半透膜,所以选A;因为胶体颗粒能通过滤纸,所以B错误;丁达尔效应产生的原因是由胶体颗粒的大小决定的,所以C错误;“纳米材料”分散在水中具有胶体的性质,所以D错误。
答案:A
1.(2010山东潍坊高三模拟)下列叙述不正确的是( )
A.气体、液体、固体都可以作为溶液的溶质
B.一杯溶液里各个部分的性质是相同的
C.酒精和水以任意比例互相溶解时,均称为酒精的水溶液
D.植物油溶入汽油中形成不稳定的乳浊液
解析:C中若是少量水溶解在酒精里,就可能看成将水作为溶质的错误结论,因当溶液中有水存在时,不论水的量有多少,一般都把水看作溶剂,故C对。植物油能溶解在汽油中形成均一、稳定的混合物,形成的是溶液而不是乳浊液,故D不对。
答案:D
10.超导体为具有零电阻及反磁性的物质,以Y2O3、BaCO3及CuO为原料,经燃烧可合成一高温超导物质YBa2Cu3Ox。现欲合成0.50 mol此高温超导体,依化学剂量比例需要Y2O3__________mol,CuO_____________mol。
解析:本题若设未知数列方程组来计算,太麻烦。若分别运用Y原子、Cu原子守恒可快速得出需要Y2O3 0.25 mol,CuO 1.5 mol。近几年高考试题中经常出现一题巧解的情况,考生只要抓住试题中的某些特征,用守恒、差量、极端假设等解题方法来解题,便显得简单快捷、准确。本题抓住Y和Cu守恒这一关键便可求解。
答案:0.25 1.5
9.已知M(Mg)=24 g·mol-1,Vm=22.4 L·mol-1,今有0.48 g金属镁与10 mL盐酸反应,计算生成的H2在标准状况下的体积?V(H2)。
(1)缺少的一个数据a是__________________(要求指出该数据的名称、符号和单位)。
(2)写出计算式:
①______________________________________________。
②______________________________________________。
解析:根据化学反应方程式:
Mg + 2HCl====MgCl2+H2↑
1 2
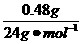 0.010 L×a mol·L-1
0.010 L×a mol·L-1
根据关系式:1∶2=0.02∶0.01a可确定a取何值时,Mg适量、HCl过量和HCl适量、Mg过量。
答案:(1)盐酸的物质的量浓度a mol·L-1-1
(2)①当c(HCl)≥4 mol·L-1时,V(H2)=0.448 L
②当c(HCl)<4 mol·L-1时,V(H2)=0.112a L
8.有一种氯化钠与氯化钾的混合物,它所含钾与钠的物质的量之比为3∶1,则
(1)混合物中氯化钾的质量分数是______________。
(2)含1 mol氯离子的该混合物的质量为_______________。
解析:(1)NaCl与KCl的物质的量之比等于Na与K的物质的量之比,即
n(NaCl)∶n(KCl)=1∶3。
设NaCl的物质的量为1 mol,则KCl的物质的量为3 mol,
w(KCl)=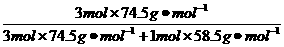 ×100%=79.3%。
×100%=79.3%。
(2)如果混合物共1 mol,因为n(NaCl)∶n(KCl)=1∶3,所以n(NaCl)=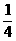 mol,?n(KCl)=
mol,?n(KCl)= mol。
mol。
m(混合物)=58.5 g·mol-1×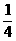 mol+74.5 g·mol-1×
mol+74.5 g·mol-1× mol=70.5 g。
mol=70.5 g。
答案:(1)79.3% (2)70.5 g
7.(1)一个典型的病毒粒子的直径是5×10-6 cm,如果把阿伏加德罗常数个这种病毒粒子紧密地排成一行,其长度为_____________ km。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是__________;A的相对原子质量是___________;ACl2的化学式是______________________________。
解析:(1)NA个病毒粒子的长度为:6.02×1023×5×10-6 cm×10-5 km·cm-1=3.01×1013 km。
(2)根据Cl-守恒可得
 ×2=0.4 mol,
×2=0.4 mol,
M=95 g·mol-1。
又因95=Ar(A)+2×35.5
解得Ar(A)=24
A为镁元素,
ACl2的化学式为MgCl2。
答案:(1)3.01×1013
(2)95 g·mol-1 24 MgCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com