
题目列表(包括答案和解析)
4.下列说法中正确的是( )
A. SO2(g) + 1/2 O2(g)
 SO3(g);
△H=-98.0KJ/mol , 1 mol SO2与1 mol O2充分反应放出的热量为98.0KJ。
SO3(g);
△H=-98.0KJ/mol , 1 mol SO2与1 mol O2充分反应放出的热量为98.0KJ。
B 2 SO2(g) + O2(g)  2SO3(g); △H1>△H(△H数值A项给出)。
2SO3(g); △H1>△H(△H数值A项给出)。
C x(g) + y(g)  z(g)
+ w(s); △H>0,平衡后加入x,△H增大。
z(g)
+ w(s); △H>0,平衡后加入x,△H增大。
D x(g) + y(g)  z(g)
+ w(s);平衡后加入少量w,x的转化率不变。
z(g)
+ w(s);平衡后加入少量w,x的转化率不变。
[解析]:A中1 mol SO2与1 mol O2反应后,没有说明SO3的状态,故A错。
B中表示2 mol SO2完全反应放出的热量,故△H1=2△H ,即△H1<△H .
C中平衡后加入x,由于没有说明是在恒温恒容条件下,还是恒温恒压条件下,故平衡移动方向不能确定,△H也就不能确定。故正确的选项是D。
3.用两支惰性电极插入500ml AgNO3溶液中,通电电解,当电解液的pH由6.0变到3.0时(设电解时阴性没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量是( )
A 27 mg B 54 mg C 108 mg D 216 mg
[解析]:根据溶液始终呈电中性可知,溶液中增加了多少的H+离子,则必有同样多的Ag+转化为Ag,以保持溶液的电中性,由已知数据可以推算出B选项为正确答案。
2.2005年1月,美国科学家在《Science》上发表论文,宣布发现Al的超原子结构 ,如Al13、Al14,并用质谱仪检测到稳定的Al13I-等,Al13、Al14的一些性质像其它的主族元素的化学性质,得到或失去电子生成40个价电子的最稳定状态。下列说法中不正确的是( )
A Al13与卤族单质的性质相似。
B Al14与第IIA族元素的性质相似。
C Al13在一定条件下与HI反应的化学方程式:Al13 + HI = HAl13I.
D Al14中的Al原子间以离子键相结合。
[解析]:根据“生成40个价电子的最稳定状态”知Al13需得到1个电子,而Al14要失去2个电子。故选D。
1.下列有关pH变化的判断中,正确的是 ( )
A 随着温度的升高,Na2CO3溶液的pH减小。
B 随着温度的升高,纯水的pH增大。
C 新制氯水经光照一段时间后,pH减小。
D 氢氧化钠久置于空气中,pH增大。
[解析]:温度升高,有利于盐类水解和水的电离,故会使Na2CO3溶液的pH增大,水的pH减小,新制氯水经光照后发生反应:2HClO  2HCl
+ O2
2HCl
+ O2 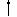 ,而NaOH溶液久置后会发生反应:2NaOH + CO2
=Na2CO3 + H2O , pH减小,故选C。
,而NaOH溶液久置后会发生反应:2NaOH + CO2
=Na2CO3 + H2O , pH减小,故选C。
1.设NA表示阿佛加德罗常数,下列说法正确的是( )
A.1mol CaC2中有3NA个离子
B.1mol SiO2中含有2NA个共价键
C.1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子
D.42g C2H4和C3H6的混合物中一定含有6NA个氢原子
命题意图:高考对NA的考查重现率很高,并且出题很灵活,涉及的知识点也较多,这一考点是学生必须掌握的。
思路点拨:A选项,C22-为一个离子;B选项,SiO2晶体中一个Si原子与4个O原子成键,1mol SiO2中含有4NA个共价键;C选项,CH3COO-离子部分水解了。
11.(14分)有机物A(C11H12O2)可调配果味香精。用含碳、氢、氧三种元素的有机物B和C为原料合成A。
(1) 有机物B的蒸汽密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3 。
有机物B的分子式为
(2)有机物C的分子式为C7H8O,C能与钠反应,不与碱反应,也不能使Br2(CCl4)褪色。
C的结构简式为 。
(3)已知两个醛分子间能发生如下反应:
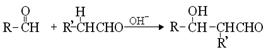
(﹣R、﹣R’表示氢原子或烃基)
用B和C为原料按如下路线合成A:

① 上述合成过程中涉及的反应类型有: (填写序号)
a取代反应;b 加成反应;c 消去反应;d 氧化反应;e 还原反应
② B转化D的化学方程式:
。
③ F的结构简式为:
。
④ G和B反应生成A的化学方程式:
。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式
10.(16分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1) X元素是
(2) X与W组成的化合物电子式为
(3) 由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(4) 由X、Y、Z、W四种元素组成的一种离子化合物A
① 已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式:
② 又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
(5) 由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶H2O。对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为:
② 已知1mol/L 100mL B的溶液能与1mol/L 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式:
9.(12分)工业用右图所示装置电解饱和食盐水
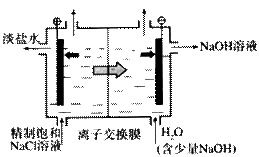
(1)阳极产物是 ;
阴极产物是 ;
能透过离子交换膜的离子是 。
(2)若精制饱和NaCl溶液进液口c(Cl-) = amol/L;淡盐水岀液口c(Cl-) = bmol/L,
假设精制饱和NaCl溶液进液口和H2O进液口流量相同,NaOH溶液岀液口的
c( OH-)约为 mol/L
(3)电解产物甲、乙之间有如下转化关系(反应条件已略):
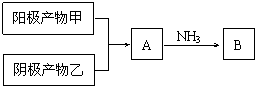
① 写出A与NH3反应的化学方程式
② 阳极产物甲能与NH3反应生成B和一种单质,写出化学方程式
③ 在100 mL水中通入a mol A后,再通入b mol NH3,若a≥b,所得溶液中离子物质的量浓度大小关系可能有:
。
8.(12分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
|
10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4
+、F- |
|
18电子粒子 |
H2S、HCl、K+ 、S2- 、HS﹣、Cl- |
(1)其中空间构型为正四面体的分子的是 ;受热最难分解的分子是 。
(2)其中能与OH-反应的分子有 ;
既能与H+反应又能与OH﹣反应的粒子有 。
(3)其中在水溶液中能够促进水电离的粒子有 ;
写出一种由表中粒子组成的离子化合物水溶液呈酸性的离子方程式
。
(4)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式
7.在一定条件下密闭容器中发生4NH3(g) + 5O2(g)
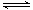 4NO (g)+ 6H2O(g) ΔH=akJ/mol
4NO (g)+ 6H2O(g) ΔH=akJ/mol
反应过程中能量变化如图所示
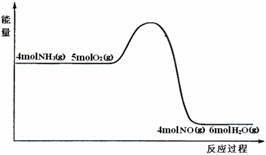
下列说法正确的是
A.由图可知a>0
B.升高温度可以提高NH3的转化率
C.反应体系中加入催化剂可增加反应热
D.将平衡混合物通入水中一定有硝酸铵生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com