
题目列表(包括答案和解析)
9. 在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)  2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1 mol SO3(g)
B.保持温度和容器内压强不变,充入1 mol SO3(g)
C.保持温度和容器内压强不变,充入1 mol O2(g)
D.保持温度和容器内压强不变,充入1 mol Ar(g)
8. 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g),637 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示,下列叙述正确的是( )
2NH3(g),637 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示,下列叙述正确的是( )
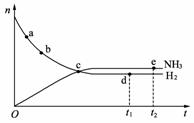
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
7. 如右图中所示的曲线是表示其他条件一定时,2NO+O2 2NO2
2NO2
(该反应放热)反应中NO的转化率与温度的关系曲线,图中标有
a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )
A.a点 B.b点 C.c点 D.d点
6. 在一定量的密闭容器中进行反应:N2(g)+3H2(g)  2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol/L,H2为0.6 mol/L
B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L
D.NH3为0.4 mol/L

5. 固体NH4I在密闭容器中受热分解发生下列反应:NH4I(s)
 HI(g)+NH3(g),2HI(g)
HI(g)+NH3(g),2HI(g)  H2(g)+I2(g),达到平衡后,c(HI)=4 mol·L-1,c(I2)=0.5 mol·L-1,下列说法中正确的是( )
H2(g)+I2(g),达到平衡后,c(HI)=4 mol·L-1,c(I2)=0.5 mol·L-1,下列说法中正确的是( )
A.平衡时,c(NH3)=5 mol·L-1
B.若改变反应起始时固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变
C.反应起始时固体NH4I是5 mol
D.平衡时HI的分解率是10%
4. (2008年高考海南卷)X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.66%
3. 某温度下在密闭容器中发生如下反应:2M(g)+N(g)
 2E(g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为( )
2E(g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为( )
A.20% B.40% C.60% D.80%
2. 可逆反应:2NO2(g)  2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
1. 下列说法可充分说明P(g)+Q(g)  S(g)+R(g),在恒温下,恒容密闭容器中的反应已达平衡的是( )
S(g)+R(g),在恒温下,恒容密闭容器中的反应已达平衡的是( )
A.容器里P、Q、R、S四种物质共存
B.容器里Q、R的体积分数不再改变
C.容器内气体压强、密度不随时间变化
D.单位时间内生成n mol P同时生成n mol Q
16. 丙酮和碘在酸性溶液中发生下列反应:
CH3COCH3+I2  CH3COCH2I+I-+H+
CH3COCH2I+I-+H+
25 ℃时,该反应的速率由下列经验式决定:
v=2.73×10-5c(CH3COCH3)c(H+) mol·L-1·s-1
25 ℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01 mol·L-1、0.1 mol·L-1、0.01 mol·L-1,求:
(1)反应开始时的速率;
(2)溶液中I2消耗一半时,反应速率比开始时慢还是快(通过计算回答)?
第二节 化学平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com