
题目列表(包括答案和解析)
15. 在一定温度下,A、B能在溶液中发生反应生成C和D:
A+B=C+D。
a.将0.2 mol/L A溶液和0.2 mol/L B溶液各20 mL混合
b.将0.5 mol/L A溶液和0.5 mol/L B溶液各50 mL混合
c.将1 mol/L A溶液和1 mol/L B溶液各10 mL混合,同时倒入30 mL蒸馏水
d.将1 mol/L A溶液20 mL和1.2 mol/L B溶液60 mL混合
反应开始时,反应速率由大到小的顺序是 。
14. 向H2SO4和H2O2溶液中滴加定量的KMnO4溶液,反应方程式为
2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O;ΔH<0
反应开始后,溶液中Mn2+的浓度将随时间变化而变化,某学生在做实验前认为Mn2+浓度与时间t的关系如下图(Ⅰ)所示。做完实验后,得到的结果却如下图(Ⅱ)所示。
请回答:
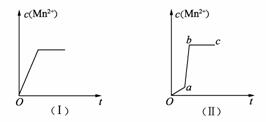
(1)Oa段的意义: 。
(2)ab段的意义: 。
(3)bc段的意义: 。
13. 反应速率v和反应物浓度的关系是用实验方法测定的,化学反应:H2+Cl2=2HCl的反应速率v可表示为v=k[c(H2)]m·[c(Cl2)]n。式中k为常数,m、n的值可用下表中数据确定。
|
c(H2)/
mol·L-1 |
c(Cl2)/
mol·L-1 |
v |
|
1.0 |
1.0 |
1.0k |
|
2.0 |
1.0 |
2.0k |
|
2.0 |
4.0 |
4.0k |
(1)由此可推算得m、n值分别为m= ,n= 。
(2)由公式可知 [填“c(H2)”或“c(Cl2)”]对反应速率的影响大。
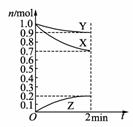
12. 某温度时,在2 L容器中,X、Y、Z三种物质的物质的量
随时间变化曲线如图所示。由图中数据分析,
该反应的化学方程式为 。
反应开始至2 min,Z的平均反应速率为 。
11. 在2 L的密闭容器中,发生以下反应:
2A(g)+B(g)  2C(g)+D(g);若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol·(L·s)-1,则10 s时,容器中B的物质的量是( )
2C(g)+D(g);若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol·(L·s)-1,则10 s时,容器中B的物质的量是( )
A.3.4 mol B.3.2 mol
C.2.8 mol D.1.2 mol
10. 某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体,达到平衡后c(X2)为0.4 mol·L-1,c(Y2)为0.8 mol·L-1,生成的c(Z)为0.4 mol·L-1,则该反应方程式(Z用X、Y表示)是( )
A.X2+2Y2 2XY2
B.2X2+Y2
2XY2
B.2X2+Y2 2X2Y
2X2Y
C.X2+3Y2 2XY3
D.3X2+Y2
2XY3
D.3X2+Y2 2X3Y
2X3Y
9. 下列说法不正确的是( )
A.增大反应物浓度,未改变单位体积内活化分子的百分数
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子中的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大化学反应速率
8. 将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g
)  2C(g)若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
7. 将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,b g(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( )

6. 对于一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中活化分子百分数的是( )
2SO3,改变下列条件,可以提高反应物中活化分子百分数的是( )
①增大压强②升高温度③加入催化剂④减小反应物浓度
A.①② B.②③ C.①②③ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com