
题目列表(包括答案和解析)
8.根据阿伏加德罗定律,下列叙述中正确的是 ( )
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.恒温恒容下两种气体的物质的量之比等于体积之比
D.同温同压下两种气体的摩尔质量之比等于密度之比
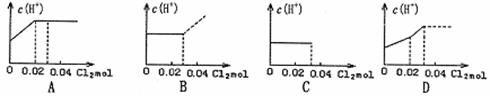
7.将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程溶液的
c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( )
6.右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是 ( )
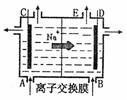 A.从E口逸出的气体是H2
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4LCl2,同时产生2molNaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制
时先加Na2CO3溶液
5.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制盐酸,流程复杂且造成浪费。
有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说
法错误的是 ( )
A.两极材料都用石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通入氯气的电极移动
D.通氯气的电极反应为Cl2+2e-===2Cl-
4. 在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(c%)与温度、
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(c%)与温度、
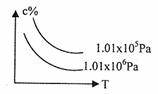 压强的关系如图所示,下列判断正确的是 ( )
压强的关系如图所示,下列判断正确的是 ( )
A.△H<0 △S>0
B.△H>0 △S<0
C.△H>0 △S>0
D.△H<0 △S<0
3.K35ClO3晶体与H37Cl溶液反应后,生成氯气、氯化钾和水,下列说法正确的是( )
A.氯化钾是还原产物
B.有两种元素的化合价发生了变化
C.被氧化的K35ClO3和被还原的H37Cl的物质的量之比为1:5
D.生成氯气的相对分子质量为73.3
2.A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,
D是其最高价氧化物对应的水化物,则A可能是 ( )
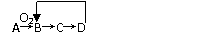
①Al ②Mg ③N2 ④S
A.①③ B.②③④ C.①②③ D.①②③④
1.下表是五种银盐的溶度积常数(25℃):
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是 ( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,x向其中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
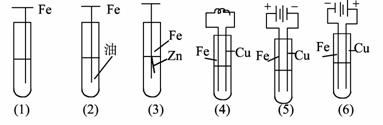
17. (2007年高考山东卷·理综)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: ,
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤: 。
|
|
氢氧化物开始 沉淀时的pH |
氢氧化物沉 淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(不可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式: 。
劣质不锈钢腐蚀的实验现象: 。
。
16. 在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A
电极,洗涤、干燥、称量,电极增重1.6 g。请回答下列问题: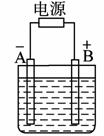
(1)B电极发生反应的电极反应式: 。
(2)写出电解时反应的离子方程式: 。
(3)电解后溶液的pH为 ,要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
(4)请你设计实验确定原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤,实验现象和实验结论。
①假设一:
。
②假设二:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com