
题目列表(包括答案和解析)
13.探究实验(根据以下操作填空)
实验步骤:Ⅰ.在两支试管中分别加入10 mL FeCl2和10 mL FeCl3溶液,各滴入几滴KSCN溶液,观察现象。
Ⅱ.在盛有FeCl2和KSCN溶液的试管里再滴加几滴新配制的氯水,观察现象。
Ⅲ.在试管里加入5 mL FeCl3溶液,加入几滴稀盐酸和适量还原铁粉、振荡一会,观察现象。
实验现象:Ⅰ中盛FeCl3溶液的试管里溶液______________,盛FeCl2溶液的试管里溶液________。Ⅱ中溶液______________。
Ⅲ中加入HCl和铁粉后,溶液________,滴加KSCN溶液后______________。
实验结论:在溶液中Fe3+遇SCN-________,Fe2+遇SCN-________。在实验室中,可用________检验Fe3+的存在。
[解析] 含Fe2+溶液为浅绿色,遇SCN-不变色,含Fe3+溶液呈黄色,遇SCN-变显红色,Fe2+易被氧化剂(如Cl2)氧化 Fe3+,Fe3+易被还原剂(如Fe)还原为Fe2+。
[答案] (1)Ⅰ.由黄色变为红色 无明显变化 Ⅱ.由浅绿色变为红色 Ⅲ.由黄色变为浅绿色 无明显现象
结论:显红色 无明显现象 含有SCN-的溶液
12.用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______________________。
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是什么?
________________________________________________________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(1)在试管Ⅰ里加入的试剂是__________________________________________________ ______________________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是什么?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是什么?______________ __________________________________________________________________________________________________________________________________。
[解析] 方法一:(1)加入还原性铁粉是为了防止Fe2+被氧化;加入稀H2SO4的目的是抑制Fe2+的水解。
(2)加热煮沸是利用了气体的溶解度随着温度的升高而降低的规律。
方法二:主要用制取的H2将试管中的空气排净,然后让Fe2+与OH-接触,没有O2,Fe(OH)2当然能保存一段时间。
[答案] 方法一:(1)少量的铁粉和稀H2SO4
(2)加热煮沸
(3)防止NaOH吸收空气中的O2避免Fe(OH)2沉淀接触O2
方法二:(1)铁屑、稀H2SO4
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的H2的纯度。当排出的H2纯净时,再夹紧止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ且外界空气不容易进入
11.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为________。
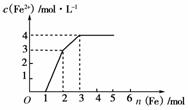
[解析] 据氧化性由强到弱的顺序HNO3>Fe3+>Cu2+,可知随铁粉的增加,反应的方程式分别为:
4HNO3+Fe===Fe(NO3)3+NO↑+2H2O
4 mol 1 mol 1 mol
2Fe(NO3)3+Fe===3Fe(NO3)2
2mol 1 mol 3 mol
Cu(NO3)2+Fe===Fe(NO3)2+Cu
1 mol 1 mol 1 mol
所以原溶液中,Fe(NO3)3、Cu(NO3)2、HNO3的物质的量之比为:(2 mol-1 mol)∶1 mol∶4 mol=1∶1∶4。
[答案] 1∶1∶4
10.向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
( )
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
[解析] 依题意,恰好反应后溶液中只存在FeCl2,根据元素守恒法,可建立关系n(Fe)=n(Fe2+)=n(Cl-)=n(HCl)=×0.1 L×1 mol·L-1=0.05 mol,m(Fe)=2.8 g。
解此题若用常规方法会非常烦琐,而用守恒法,从整体角度去思考,则非常简捷。质量守恒是化学的一个重要定律,在解题中经常用到。
[答案] C
9.在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是
( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3∶2∶3
D.明矾属硫酸盐,含结晶水,是混合物
[解析] A选项中铝热剂不单指Al粉和Fe2O3,还包括其他许多,如Al粉和V2O5、Al粉和MnO2等等,A错。
B选项中Fe2O3为不溶于水的物质,应加盐酸溶解后再加KSCN溶液,B错。
C.根据电子守恒,a mol Fe2O3变为Fe需6a mol电子,故H2、Al、CO的物质的量为3a、2a、3a,所以三者之比为3∶2∶3,故C对。
D.明矾为KAl(SO4)2·12H2O,是纯净物,D错。
[答案] C
8.a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
( )
A.1∶7 B.7∶1
C.7∶8 D.8∶7
[解析] 可设参加反应的H2SO4的物质的量为x,则根据电子得失守恒有×2=×2+2x,求得x=,则参加反应的CuSO4和H2SO4的物质的量之比为∶=7∶1,故选B。
[答案] B
7.向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现血红色,由此得出下列的结论错误的是
( )
A.Fe3+的氧化性比溴的氧化性强
B.该晶体中一定含有SCN-
C.Fe2+与SCN-不能形成血红色化合物
D.Fe2+被溴氧化成Fe3+
[解析] 某晶体的溶液中没有与Fe2+发生反应的离子,当加入溴水后,Fe2+一定被氧化成Fe3+,此时溶液出现血红色,说明原晶体是含有SCN-的盐,很明显判断出B、C、D均正确,在Br2与Fe2+反应中,Fe3+是氧化产物,Br2是氧化剂,所以Br2的氧化性应比Fe3+的氧化性强,选项A符合题意。
[答案] A
6.把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
( )
A.SO2 B.Fe2+
C.Fe3+ D.NO
[解析] SO2具有还原性,Fe3+具有氧化性,二者反应生成Fe2+和H2SO4,溶液由棕黄色变为浅绿色,由于溶液中还存在NO,H+与NO又将Fe2+氧化生成Fe3+,溶液又由浅绿色变为棕黄色,加入BaCl2溶液产生白色沉淀,说明SO2已被氧化成SO,所以最终被还原的是NO。
[答案] D
5.在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是
( )
①有Fe2+ ②Fe2+和Fe3+
③Fe2+和Cu2+ ④Cu2+和Fe3+
A.①③ B.②④
C.①④ D.②③
[解析] 题中“滤出固体”说明是单质Cu或Cu、Fe的混合物,则溶液一定没有Fe3+,一定有Fe2+,可能有Cu2+。
[答案] A
4.在浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液颜色变化应是
( )
A.颜色变浅 B.逐渐变深绿
C.没有改变 D.变棕黄色
[解析] Fe(NO3)2溶液中加入盐酸时发生反应:3Fe2++4H++NO===3Fe3++NO↑+2H2O,有棕黄色的Fe3+生成。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com