
题目列表(包括答案和解析)
12.某强酸性溶液中可能存在NO-3、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,溴被还原,由此推断该溶液中 ( )
A.不含NO-3,也不含Fe3+ B.含有NO-3、I-、Cl‑
C.含I-,但不能确定是否含Cl- D.含有Fe3+
解析:NO-3、I-、Cl-、Fe3+四种离子中只有I-能被Br2氧化,所以溶液中必存在I-;
由于在强酸性溶液中NO-3和Fe3+都能把I-氧化,即NO-3、Fe3+都不能跟I-共存;
Cl-不参与反应,所以无法确定它的存在与否。
答案:AC
11.在科技活动晚会上,某同学向甲、乙两张白纸上分别喷洒两种不同的试剂,甲变成一幅蓝色图画,乙变成一幅红色图画,下列叙述不正确的是 ( )
A.甲中的图画事先由淀粉溶液作成,后来喷洒的是碘水
B.乙中的图画事先由NaClO溶液作成,后来喷洒的是酚酞溶液
C.乙中的图画事先由酚酞作成,后来喷洒的是NaOH溶液
D.甲、乙两张纸上均发生了化学反应
解析:ClO-有强氧化性,具有漂白性,可使红色消失。
答案:B
10.鉴别NaCl、NaBr、NaI可以选用的试剂是( )
A.碘水、淀粉溶液 B.氯水、CCl4溶液
C.溴水、苯 D.硝酸、AgNO3溶液
解析:可溶性卤化物可用下列两种方法鉴别:
(1)在3种试样中各取少许,分别加入氯水,再加入CCl4后振荡、静置。液体分层,下层
为紫红色的原试样为碘化物;因为Cl2+2I-===2Cl-+I2,生成的I2被CCl4萃取呈紫
红色;同理,下层为橙红色的原试样为溴化物;另一种会在下层出现黄绿色则为氯化物,
因为Cl2溶解在CCl4层中。
(2)在3种试样中各取少许,分别滴加AgNO3溶液和稀HNO3,产生的白色沉淀是AgCl,
原试样为氯化物;产生的浅黄色沉淀是AgBr,原试样为溴化物;产生的黄色沉淀为AgI,
原试样为碘化物。
答案:BD
9.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2中不同价态的氯在酸性条件下可以生成Cl2。下列关于混盐CaOCl2的说法中不正确的是( )
A. CaOCl2与稀硫酸反应产生1 mol Cl2时转移2 mol电子
B.CaOCl2的水溶液呈碱性
C.CaOCl2具有较强的氧化性
D.CaOCl2中氯元素的化合价为0
解析:根据信息“一种阳离子与两种酸根离子组成的盐称为混盐”,该混盐应写成CaCl(ClO),结构中存在Cl-和ClO-两种阴离子,产生1 mol Cl2时转移1 mol电子。
答案:AD
8.0.2 mol某元素的单质与足量的Cl2反应后,质量增加了21.3 g,这种元素是( )
A.Cu B.Na C.Fe D.Al
解析:n(Cl2)=0.3 mol,转移0.6 mol e-,说明0.2 mol金属单质也转移0.6 mol e-,化合价为+3价。
答案:CD
7. 实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多 C.一样多 D.无法比较
解析:146 g HCl的物质的量为4 mol,87 g MnO2的物质的量为1 mol,由方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,1 mol MnO2可以与4 mol HCl反应,但是,应注意稀盐酸与MnO2不反应的事实,也就是说1 mol MnO2与足量浓盐酸反应生成的Cl2多。
答案:B
6.浓盐酸和次氯酸钙能发生下列反应:
Ca(ClO)2+4HCl(浓) CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
①CO2 ②HCl ③H2O(g) ④O2
A.①②③ B.②③④ C.②③ D.①④
解析:Ca(ClO)2会在空气中吸收CO2而转变为CaCO3,故当用久置的漂白粉与浓HCl反应制Cl2时,可能引入的杂质性气体是CO2、HCl及H2O(g)。
答案:A
5.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
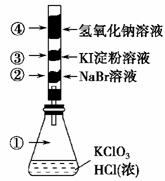
|
|
① |
② |
③ |
④ |
|
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
|
B |
无色 |
橙色 |
紫色 |
白色 |
|
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
|
D |
黄绿色 |
无色 |
紫色 |
白色 |
解析:各处发生的反应及现象分别为:
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,产生黄绿色的气体。
②2NaBr+Cl2===2NaCl+Br2,Br2溶于水显橙(黄)色。
③2KI+Cl2===2KCl+I2,淀粉遇I2变蓝色。
④Cl2+2NaOH===NaCl+NaClO+H2O,两种盐的水溶液都无颜色,故棉球显白色。
答案:A
4.将0.2 mol MnO2和50 mL 12 mol·L-1的盐酸混合后加热,待反应完全后,向反应后的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(盐酸的挥发忽略不计)( )
A.大于0.3 mol,小于0.6 mol B.等于0.3 mol
C.小于0.3 mol D.等于0.6 mol
解析:n(HCl)=0.050 L×12 mol·L-1=0.6 mol。HCl-AgCl,0.6 mol HCl不与MnO2反应时生成的AgCl最多,为0.6 mol。HCl为0.6 mol,最多生成0.15 mol Cl2;由于盐酸浓度减小到一定程度时,MnO2不与盐酸反应,故判断A项正确。
答案:A
3.氯气溶于水后生成氯水,在氯水中存在的平衡关系是( )
①氯气与水反应的化学平衡 ②次氯酸的电离平衡 ③水的电离平衡 ④氯气溶解与逸出的平衡
A.①②③ B.①②④ C.②③④ D.都存在
解析:氯水中存在的变化过程有:Cl2(g) Cl2(aq)
Cl2(aq)
Cl2+H2O HClO+HCl
HClO+HCl
HClO ClO-+H+
ClO-+H+
H2O H++OH-。
H++OH-。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com